- Tổng quan
- 1. Giới thiệu về Sulforaphane và Selen – lưu huỳnh
- 2. Kết quả của nghiên cứu
- 2.1. Ảnh hưởng của xử lý S và Se đến hàm lượng S và Se tổng số trong bông cải xanh
- 2.2. Ảnh hưởng của xử lý S và Se đến hàm lượng Met và Se-SMC trong bông cải xanh
- 2.3. Ảnh hưởng của việc xử lý S và Se đối với hàm lượng GL trong bông cải xanh
- 2.4. Ảnh hưởng của việc xử lý S và Se đến hoạt động của myrosinase và năng suất SF ở bông cải xanh
- 2.5. Ảnh hưởng của việc xử lý S và Se đối với sự biểu hiện của các gen sinh tổng hợp GL trong bông cải xanh
- 3. Kết luận
- 4. Các chủ đề liên quan
- 5. Tham vấn chuyên môn
Hợp chất selen – lưu huỳnh và ảnh hưởng như thế nào đến quá trình đồng hóa Sulforaphane trong bông cải xanh? GLs trong bông cải xanh đã được phân tách bằng UPLC.
Tổng quan
Ảnh hưởng của việc xử lý S (dưới dạng sulphat) và Se (dưới dạng selen) (S mM / Se μM: 1/0, 1/50, 1/100, 1/150, 4/0, 4/50, 4/100, và 4/150) tới việc sản xuất Sulforaphane (một hợp chất chống ung thư), sự tích tụ tiền chất của nó và sự biểu hiện của các gen liên quan đến sinh tổng hợp glucoraphanin trong bông cải xanh đã được nghiên cứu và kiểm tra. Năng suất Sulforaphane và hoạt tính myrosinase tăng lên đáng kể khi sử dụng kết hợp 4 mM S và 100 μM Se trên bông cải xanh.
Hơn nữa, nồng độ của Glucoraphanin (một tiền chất Sulforaphane) và Methionine (một cơ chất glucoraphanin) đã thay đổi một chút sau khi sử dụng Se. Và hoạt tính chống ung thư mạnh mẽ của hợp chất Se – SMC đã được cải thiện hơn. Phân tích biểu hiện gen liên quan cho thấy MY, mã hóa myrosinase, được gây ra bởi xử lý Se. Do đó, hoạt tính myrosinase gây ra bởi xử lý Se là yếu tố chi phối ảnh hưởng đến sản lượng Sulforaphane từ quá trình thủy phân glucoraphanin. Quá trình lọc sinh học selen-lưu huỳnh cung cấp hỗ trợ kỹ thuật cho việc trồng bông cải xanh với hàm lượng Sulforaphane cao và các hợp chất selen chống ung thư cao.
1. Giới thiệu về Sulforaphane và Selen – lưu huỳnh
Bông cải xanh [Brassica oleracea L. var. italica Planck (họ Cải)] rất giàu các hợp chất chống ung thư, chống oxy hóa và tăng cường sức khỏe, chẳng hạn như Sulforaphane (4–methylsulfinylbutyl isothiocyanate, SF), các hợp chất polyphenolic và vitamin C (Tian và cộng sự, 2016). SF được thủy phân từ glucoraphanin (RAA), một glucosinolate béo và gây ra hoạt động của các enzym pha 2 có thể chuyển hóa chất gây ung thư thành các chất chuyển hóa không hoạt động (Nakagawa và cộng sự, 2006; Yeh và Yen, 2009). Tăng tiêu thụ SF có thể làm giảm nguy cơ mắc các bệnh ung thư khác nhau, đặc biệt là bàng quang, ruột kết và phổi (Cartea và Velasco, 2008); bệnh tim mạch; thoái hóa thần kinh, tiểu đường; và một số rối loạn viêm (Bello và cộng sự, 2018).
Glucosinolate (β – thioglucoside N – hydroxysulphates, GL), là chất chuyển hóa chuyên biệt giàu lưu huỳnh được tìm thấy trong rau Brassica và đã được khám phá rộng rãi vì tác dụng của chúng đối với sức khỏe con người. GL tồn tại chủ yếu trong hầu hết các loại bông cải xanh bao gồm RAA, glucoerucin và glucobrassicin. Khi bông cải xanh bị cắt nhỏ, bị hư hỏng cơ học hoặc bị sâu bệnh tấn công, glucosinolate liên kết trực tiếp với myrosinase và sau đó được chuyển đổi thành isothiocyanates (ITC), chẳng hạn như SF, erucin và iberin (Latt´e và cộng sự, 2011), là những chất chống ung thư các đại lý. Các gen mã hóa các enzym có liên quan đến quá trình sinh tổng hợp GL, chẳng hạn như sự kéo dài chuỗi bên của các axit amin tiền thân, sự hình thành cấu trúc GL lõi và trang trí của chuỗi bên, đã được xác định gần đây (Sønderby và cộng sự, 2010).
Lưu huỳnh là một chất dinh dưỡng thực vật thiết yếu được kết hợp vào protein thông qua các axit amin cysteine và methionine (Met), tham gia vào nhiều phản ứng oxy hóa / khử trong quá trình trao đổi chất của thực vật và có thể được đưa vào các chất chuyển hóa chuyên biệt, chẳng hạn như GL (Barickman et al. , 2013).
Là một phần của các nguyên tố nhóm VI – A, dinh dưỡng S và Se đã được chú ý do các đặc điểm vật lý và hóa học tương tự nhau và sự liên kết chặt chẽ với quá trình trao đổi chất của thực vật. Quá trình lọc sinh học Se bị ảnh hưởng mạnh bởi nồng độ của sunphat đối thủ cạnh tranh; sự tích lũy Se tăng lên trong thực vật có thể ảnh hưởng đến quá trình tổng hợp các hợp chất liên quan đến S; Se và S ở nồng độ thấp tạo ra hiệu ứng hiệp đồng (Tian và cộng sự, 2016; Dall’Acqua và cộng sự, 2019). Do đó, ứng dụng Se có thể ảnh hưởng đến sự tích tụ sulfocompound-GL trong các cơ quan khác nhau của thực vật.
Charron và cộng sự (2001) phát hiện ra rằng tăng mức Se làm giảm tổng hàm lượng GL. Do Se dễ dàng tích lũy trong các loài Brassica thông qua con đường đồng hóa S, các chất chuyển hóa này phải được phân tích để đánh giá tác động trao đổi chất của chúng đối với GL và ITC. Điều chỉnh chuyển hóa Se / S trong bông cải xanh có thể có khả năng giảm thiểu ảnh hưởng của tình trạng Se cao đối với mức SF (Huang và cộng sự, 2015). Sự tích tụ GL đã được nghiên cứu rộng rãi; tuy nhiên, tác động của việc xử lý Se và S đối với quá trình sinh tổng hợp GL vẫn chưa được hiểu rõ (Sønderby và cộng sự, 2010; Sams và cộng sự, 2011).

Thực phẩm giàu Se đã nhận được sự quan tâm nghiên cứu vì lợi ích sức khỏe của chúng, và các dạng selen khác nhau đã được sử dụng để khảo sát khả năng cây trồng hấp thụ và đồng hóa nguyên tố này, đồng thời xác định ảnh hưởng của liều lượng lên sự phát triển và trao đổi chất của cây trồng, (Zagrodzki et cộng sự, 2020; Penas và cộng sự, 2018). So với hợp chất selen, selenat dễ được thực vật hấp thụ hơn, nhưng việc hấp thụ quá nhiều selen sẽ gây độc cho thực vật hoặc vượt quá mức tiêu thụ hàng ngày tối ưu của cơ thể con người (da Silva và cộng sự, 2020; Li và cộng sự, 2018).
Trong nghiên cứu này, selen được sử dụng làm nguồn để khám phá chất nền và các sản phẩm trung gian tích tụ và chuyển hóa trong con đường tổng hợp GL, bao gồm tổng Se và S, Met, Se – methylselenocysteine (Se – MSC) và GL, và để phát hiện hoạt động của myrosinase bị ảnh hưởng bởi Se để tạo ra SF (Tian và cộng sự, 2016). Ngoài ra, sự biểu hiện của các gen liên quan (BCAT3, MAM1, MAM3, CYP79F1, CYP83A1, UGT74C1, SUR1, ST5b, MYB28, MYB76 và MY) đã được kiểm tra. Nghiên cứu hiện tại nhằm mục đích giải thích những ảnh hưởng của tương tác Se-S đối với hệ thống năng suất SF trong bông cải xanh thu hoạch từ góc độ sinh lý học trao đổi chất và ở cấp độ phân tử.
2. Kết quả của nghiên cứu
2.1. Ảnh hưởng của xử lý S và Se đến hàm lượng S và Se tổng số trong bông cải xanh
Bông cải xanh được trồng trên môi trường không đất trong nhà kính trong 6 tuần với xử lý S cao (4 mM) và thấp (1 mM) trên rễ và bón bổ sung Se (Na2SeO3) ( 0, 50, 100 và 150 μM) phun trên lá. Tổng hàm lượng S cao hơn đáng kể trong lá ở mức 12,96–17,63 mg / g DW so với trong bông hoa ở mức 8,56–10,10 mg / g DW (P <0,01) (Hình 1A và B).
Trong điều kiện xử lý S thấp (1 mM), hàm lượng S tổng số trong lá ban đầu tăng, sau đó giảm và đạt giá trị lớn nhất (17,27 mg / g DW) ở nghiệm thức 50 μM Se (Hình 1A). Tuy nhiên, khi xử lý S (4 mM) và Se cao, hàm lượng S thay đổi nhẹ trong lá và bông hoa (Hình 1A và B).
Phương pháp điều trị đạt được mức Se có lợi cho việc sử dụng trong chế độ ăn uống của con người (Avila và cộng sự, 2014). Nồng độ Se trong lá và bông hoa tăng lên khi xử lý Se (Hình 1C và D). Ở nghiệm thức S thấp, nồng độ Se tổng số trong lá đạt mức cao nhất là 6,87 μg / g (DW) ở nghiệm thức 150 μM Se; tuy nhiên, hàm lượng Se trong bông hoa đạt được mức cao nhất trong điều kiện S thấp với nghiệm thức 100 μM Se (5,92 μg / g DW). Mối tương quan thuận cực kỳ có ý nghĩa (P <0,01) được tìm thấy đối với việc bổ sung Se và nồng độ Se trong bông cải xanh. Hệ số tương quan giữa liều lượng bón Se và hàm lượng Se trong hoa và lá lần lượt là 0,963 và 0,929 ở nghiệm thức S cao và 0,916 và 0,995 ở nghiệm thức S thấp.

Hình 1. Tổng hàm lượng S của lá (A) và bông hoa (B), tổng hàm lượng Se của lá (C) và bông hoa (D) dưới S (1, 4 mM), Se (0, 50, 100, 150 μM ) sự đối xử. Thanh màu xanh lam, xử lý 0 μM Se; thanh màu đỏ, xử lý 50 μM Se; thanh màu xanh lá cây, xử lý 100 μM Se; thanh màu vàng, xử lý 150 μM Se. Các thanh đại diện cho các phương tiện số học; thanh lỗi đại diện cho SD từ ba thử nghiệm độc lập. Các giá trị với các chữ cái khác nhau có sự khác biệt đáng kể ở p <0,01. (Để giải thích các tham chiếu đến màu sắc trong chú giải hình này, người đọc được tham khảo phiên bản Web của bài viết này.)
2.2. Ảnh hưởng của xử lý S và Se đến hàm lượng Met và Se-SMC trong bông cải xanh
Xử lý Se làm giảm hàm lượng Met ở nghiệm thức S thấp so với đối chứng, và không có thay đổi đáng kể nào xảy ra khi xử lý lưu huỳnh cao (Hình 2A). Nồng độ Se – SMC đạt đỉnh (5,59 μg / g DW) ở nghiệm thức S cao là 100 μM Se, giảm nhẹ ở nghiệm thức S thấp và tăng đột ngột với 150 μM Se (Hình 2B).
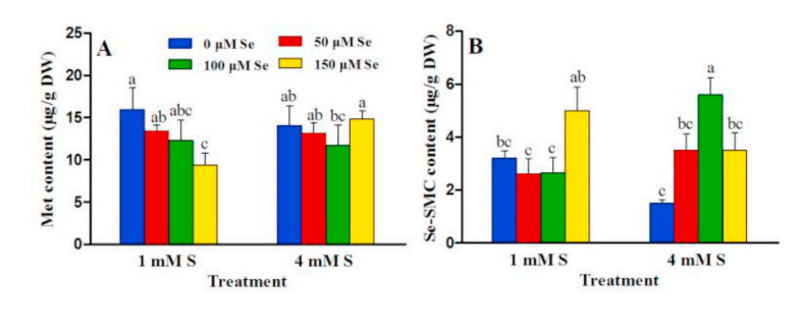
Hình 2. Hàm lượng Methionine, Met (A) và Semethylselenocysteine, Se-SMC (B) trong bông cải xanh khi xử lý S (1,4 mM), Se (0, 50, 100, 150 μM). Thanh màu xanh lam, xử lý 0 μM Se; thanh màu đỏ, xử lý 50 μM Se; thanh màu xanh lá cây, xử lý 100 μM Se; thanh màu vàng, xử lý 150 μM Se. Các thanh đại diện cho các phương tiện số học; thanh lỗi đại diện cho SD từ ba thử nghiệm độc lập. Các giá trị với các chữ cái khác nhau là khác nhau có ý nghĩa thống kê ở p <0,05. (Để giải thích các tham chiếu đến màu sắc trong chú giải hình này, người đọc được tham khảo phiên bản Web của bài viết này.)
2.3. Ảnh hưởng của việc xử lý S và Se đối với hàm lượng GL trong bông cải xanh
GLs trong bông cải xanh đã được phân tách bằng UPLC và được xác định bởi MS. Mười hai GL, bao gồm bảy GL béo, bốn GL tự phát và một GL thơm (Bảng 1), đã được xác định từ hoa cúc. Sáu GL chính bao gồm bốn GL béo, cụ thể là RAA, glucoerucin (GER), n – hexyl – glucosinolate (NHG), và gluconapin (GAP), và hai GL indole, cụ thể là 4 – methoxyglucobrassicin và glucobrassicin. Các hợp chất này chiếm khoảng 78,3% tổng hàm lượng GL (Bảng 1).
Bảng 1
Xử lý Se và S đối với nồng độ glucosinolate (GLs) trong mô floret (n = 3).
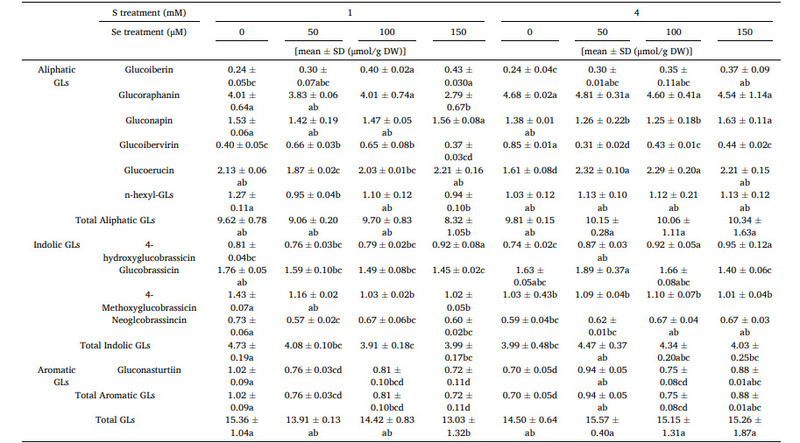
Bảng 1 cho thấy dưới nghiệm thức 1 mM S, tổng hàm lượng GL giảm khi xử lý Se tăng lên. Tổng hàm lượng GL đã giảm nhẹ khi xử lý Se ở liều lượng 50 và 100 μM và cho thấy sự suy giảm gần như 15,1% với nghiệm thức 150 μM Se.
Trong ba nhóm GL này, tổng GL béo tạo thành tỷ lệ lớn nhất trong tổng GL, khoảng 65,7%. RAA, tiền chất của SF và GL chiếm ưu thế trong số GL béo, dao động từ 2,79 μmol / g DW đến 4,81 μmol / g DW sau khi ứng dụng kết hợp Se và S. Mặc dù sự giảm RAA trong phản ứng với điều trị Se thấp (50 μM Se) là không đáng kể, nhưng sự suy giảm đáng kể nồng độ RAA khoảng 28,5% (150 μM Se) đã được tìm thấy. Ngược lại, xử lý S cao không ảnh hưởng đáng kể đến sự tích tụ RAA.
Kết quả này cho thấy có sự tương tác cạnh tranh giữa tích lũy Se và sinh tổng hợp GL. Tuy nhiên, sự tương tác này phụ thuộc vào liều lượng S và Se, và S đóng vai trò hàng đầu trong sự phong phú của RAA trong sự thụ tinh S và Se thấp (50 và 100 μM). Dưới 4 mM S với sự thụ tinh của Se (150 μM), Se là yếu tố chính gây ra sự tích tụ RAA. GER, GAP và NHG cũng có mặt với số lượng cao trong tổng hàm lượng GL béo tương ứng khoảng 21,8%, 15,1% và 11,3%. GER dao động từ 1,61 μmol / g DW đến 2,32 μmol / g DW, GAP dao động từ 1,25 μmol / g DW đến 1,63 μmol / g DW, và NHG dao động từ 0,94 μmol / g DW đến 1,27 μmol / g DW (Bảng 1). GL cảm ứng chiếm khoảng 28,7% tổng hàm lượng GL (Bảng 1). Việc bổ sung Se ảnh hưởng tiêu cực đến hàm lượng indole GL so với đối chứng trong điều kiện xử lý 1 mM S. Tuy nhiên, không có hiệu quả đáng kể nào được tìm thấy trong số ba nghiệm thức Se. GL thơm được phát hiện từ các bông hoa dao động từ 0,70 μmol / g DW đến 1,02 μg / g DW tạo thành tỷ lệ 5,6% trong tổng GL.
2.4. Ảnh hưởng của việc xử lý S và Se đến hoạt động của myrosinase và năng suất SF ở bông cải xanh
Hoạt động của myrosinase, một RAA hydrolase thành SF, được phát hiện trong bông súp lơ xanh với xu hướng tăng lúc đầu và sau đó là xu hướng giảm. Các nghiệm thức S cao và thấp thu được hoạt tính cao nhất sau nghiệm thức 100 μM Se. Mặc dù không tìm thấy sự khác biệt nào giữa ba nghiệm thức Se trong điều trị S cao. Hoạt tính myrosinase ở nghiệm thức Se cao hơn so với đối chứng (Hình 3A). Những thay đổi về năng suất SF khi xử lý kết hợp S và Se được thể hiện trong Hình 3B. Xu hướng thay đổi hàm lượng SF đầu tiên tăng và sau đó giảm, và phát hiện này phù hợp với xu hướng biến đổi của hoạt động myrosinase (Hình 3B). Nghiệm thức S cao và thấp thu được hàm lượng cao nhất với nghiệm thức 100 μM Se. Nồng độ SF cao nhất được phát hiện trong bông cải xanh là 5,32 μmol / g DW sau khi xử lý 100 μM Se kết hợp với xử lý S cao. Nồng độ SF ở nghiệm thức Se cao hơn so với đối chứng.
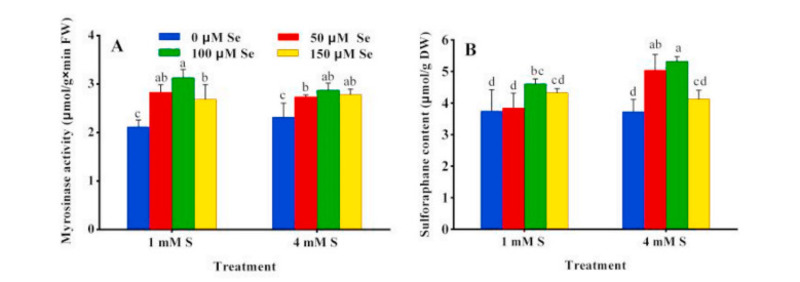
Hình 3. Hoạt động myrosinase (A) và hàm lượng sulforaphane (B) trong bông cải xanh khi xử lý S (1, 4 mM), Se (0, 50, 100, 150 μM). Thanh màu xanh lam, xử lý 0 μM Se; thanh màu đỏ, xử lý 50 μM Se; thanh màu xanh lá cây, xử lý 100 μM Se; thanh màu vàng, xử lý 150 μM Se. Các thanh đại diện cho các phương tiện số học; thanh lỗi đại diện cho SD từ ba thử nghiệm độc lập. Các giá trị với các chữ cái khác nhau là khác nhau có ý nghĩa thống kê ở p <0,05. (Để giải thích các tham chiếu đến màu sắc trong chú giải hình này, người đọc được tham khảo phiên bản Web của bài viết này.)
2.5. Ảnh hưởng của việc xử lý S và Se đối với sự biểu hiện của các gen sinh tổng hợp GL trong bông cải xanh
Những thay đổi trong biểu hiện gen liên quan đến con đường đồng hóa GL đã được nghiên cứu thêm để giải thích cơ chế của việc tăng sản xuất SF dưới 4 mM S và xử lý 100 μM Se ở cấp độ phân tử. Sự biểu hiện của 11 gen được xác định bởi RT-qPCR (Hình 4). Trong số các gen này, tám gen sinh tổng hợp GL (BCAT3, MAM1, MAM3, CYP79F1, CYP83A1, SUR1, UGT74C1 và ST5b), hai gen là yếu tố phiên mã (MYB28 và MYB76), và một gen MY mã hóa myrosinase thủy phân RAA thành SF (Wu và cộng sự, 2013). Trong số tám gen chức năng này, chỉ có ST5b được điều chỉnh tương đối sau khi xử lý 4 mM S và 100 μM Se. Biểu hiện của BCAT3, MAM1, CYP79F1, CYP83A1, SUR1 và UGT74C1 chỉ được sửa đổi một chút, nhưng biểu hiện MAM3 giảm. Ngoài tác động của các yếu tố phiên mã, MYB28 đã được điều chỉnh giảm. Tuy nhiên, không có thay đổi đáng chú ý nào đối với MYB76. Sự biểu hiện của MY, mã hóa các enzym thủy phân, đã tăng lên đáng kể (P <0,05).
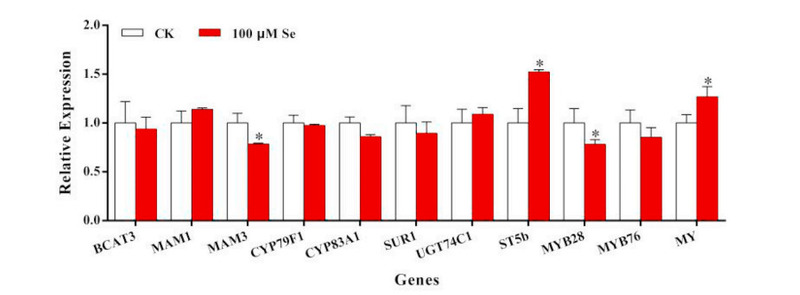
Hình 4. Mức độ biểu hiện của gen trong con đường sinh tổng hợp glucosinolate ở bông cải xanh khi xử lý S (4 mM), Se (0, 100 μM). thanh trắng, xử lý 0 μM Se; thanh màu đỏ, xử lý 100 μM Se. Các thanh đại diện cho các phương tiện số học; thanh lỗi đại diện cho SD từ ba thử nghiệm độc lập. Các giá trị có dấu hoa thị khác nhau có ý nghĩa ở p <0,05. (Để giải thích các tham chiếu đến màu sắc trong chú giải hình này, người đọc được tham khảo phiên bản Web của bài viết này.)
3. Kết luận
Sự giống nhau về mặt hóa học và vật lý giữa Se và S đã thiết lập mối quan hệ cạnh tranh đồng hóa của chúng trong bông cải xanh. Lợi thế cạnh tranh phụ thuộc vào liều lượng điều trị kết hợp S và Se. Cơ chế của con đường sinh tổng hợp SF trong bông cải xanh trưởng thành đã được nghiên cứu sau khi thu hoạch, và vai trò chính của năng suất SF và hoạt động myrosinase được gây ra khi xử lý Se. Phương pháp điều trị tốt nhất là 100 μM Se và 4 mM S tạo ra năng suất SF cao và cải thiện đáng kể hợp chất hoạt động chống ung thư mạnh – Se – SMC. Quá trình lọc sinh học Se kết hợp với xử lý S cao đã cung cấp hỗ trợ kỹ thuật cho việc trồng bông cải xanh với hàm lượng Sulforaphane cao và các hợp chất selen chống ung thư cao. Hơn nữa, tổng quan chung về xu hướng biểu hiện gen với hàm lượng RAA và sự thủy phân của nó để tạo ra SF được minh họa trong (Hình 5).
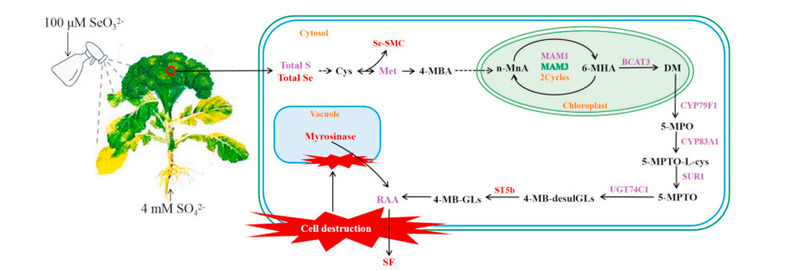
Hình 5. Tổng quan chung về hàm lượng chất chuyển hóa, hoạt động myrosinase và những thay đổi biểu hiện gen khi xử lý S và Se; đỏ, tăng lên; màu tím, không thay đổi; xanh, giảm; Cys, Cysteine; Met, Methionin; Se – MSC, Se – methylselenocysteine; 4 – MBA, axit 2 – Oxo – 4 – metylthiobutanoic; 6 – MHA, axit hexanoic 2 – Oxo – 6 – metylthio; DM, Dihomomethionine; MPO, 5 – Methylthiopentanaldoxime; 5 – MPTO – L – cys, S– (5 – Methylthiopentylthiohydroximoyl) –L – cysteine; 5 – MPTO, 5 – Methylthiopentylthiohydroximate, 4 – MB – desulGL, 4 – Methylthiobutyl – desulfoglucosinolate; 4 – MB – GL, 4 – Methylthiobutyl glucosinolate; RAA, glucoraphanin; SF, sulforaphane. (Để giải thích các tham chiếu đến màu sắc trong chú giải hình này, người đọc được tham khảo phiên bản Web của bài viết này.)
4. Các chủ đề liên quan
Dưới đây là một số bài viết về các chủ đề nghiên cứu có liên quan đến hoạt chất Sulforaphane và công dụng của chúng:
- Chế độ ăn uống có chiết xuất bông cải xanh giàu Sulforaphane giúp bảo vệ tim khỏi căng thẳng tim cấp tính
- Tác dụng bảo vệ của chiết xuất bông cải xanh và Sulforaphane chống lại sự căng thẳng oxy hóa
- Sulforaphane : Một sản phẩm tự nhiên chống lại các loại oxy phản ứng
5. Tham vấn chuyên môn
- Bác sĩ
- Nguồn tham khảo: https://www.sciencedirect.com/science/article/abs/pii/S0031942220300923

