- 1. Nguyên liệu và phương pháp
- 2. Các kết quả của thí nghiệm
- 3. Kết luận
- 4. Các chủ đề liên quan
- 5. Tham vấn chuyên môn
Bảo vệ tim do rối loạn nhịp tim có thể gây nên một số tình trạng bệnh lý. Sulforaphane từ bông cải xanh giúp bảo vệ tim khỏi rối loạn nhịp tim như thế nào?
Rối loạn nhịp tim là một nguyên nhân phổ biến gây nên một số tình trạng bệnh lý ở người. Quan trọng là, nguy cơ rối loạn nhịp tim tăng lên có liên quan đến căng thẳng oxy hóa toàn thân và kích hoạt hệ thống thần kinh tự chủ. Do đó, chúng tôi đưa ra giả thuyết rằng việc bổ sung chất chống oxy hóa trong chế độ ăn uống có thể giúp giảm rối loạn nhịp tim do căng thẳng gây ra. Sulforaphane (SFN), một isothiocyanate có trongBrassicaceaes,được công nhận là một hợp chất tăng cường sức khỏe mạnh mẽ với các đặc tính chống oxy hóa. Sau đó, chúng tôi tạo ra chiết xuất bông cải xanh (BE) giàu SFN và xác định xem việc bổ sung BE bằng đường uống có bảo vệ tim mạch trong căng thẳng tim cấp tính ở chuột hay không. BE làm giảm truyền động giao cảm tim và tăng điều hòa tim phó giao cảm được chứng minh bằng sự thay đổi tần số tim (HRV). Ngoài ra, căng thẳng tim do isoproterenol (một tác nhân giống thần kinh giao cảm) gây ra tăng ~ 4 lần tỷ lệ rối loạn nhịp tim và tác dụng này gần như bị loại bỏ hoàn toàn khi điều trị BE. Kết luận, việc bổ sung BE trong chế độ ăn uống có tác dụng điều chỉnh cơ chế tự động của tim và bảo vệ tim khỏi căng thẳng cấp tính của tim.
1. Nguyên liệu và phương pháp
1.1. Chuẩn bị chiết xuất bông cải xanh

Đầu bông cải xanh ( Brassica oleracea var. Italica ) cv. Imperial được cung cấp bởi Agrocesar Ltda (Curacaví, Chile). Đầu bông cải xanh rửa sạch, cắt thành miếng rộng 3 cm, và 400 g miếng bông cải xanh được chần ở nhiệt độ 57°C trong 13 phút trong nồi cách thủy ổn nhiệt (Stuart, Vương quốc Anh). Sau đó, các miếng bông cải xanh được làm khô trong không khí ở 60°C, cho đến khi đạt được độ ẩm 40%. Bông cải xanh khử nước được đồng nhất, nghiền thành bột và trộn với metylen diclorid và natri sulfat khan (4 L metylen diclorid và 40 g natri sulfat khan trên 100 g bông cải xanh đã được khử nước). Dịch chiết sau đó được thu hồi bằng cách lọc (bộ lọc PVDF 0,22 µm) và được cô đặc trong thiết bị bay hơi quay.
1.2. Xác định phân tích và xác định đặc tính của chiết xuất bông cải xanh
1.2.1. Hàm lượng Sulforaphane và glucoraphanin
SFN và glucoraphanin (GFN) được định lượng bằng HPLC pha ngược theo phương pháp được đề xuất bởi Kenneth (1990) và Liang và cộng sự, 2006 , Francisco và cộng sự, 2009. Tất cả các hóa chất đều là loại HPLC và được mua từ Merck (Darmstadt, Đức).
1.2.2. Tổng số hợp chất phenolic
Phương pháp Folin-Ciocalteau được sử dụng để ước tính tổng số hợp chất phenolic (TPC) ( Faller & Fialho, 2009 ). Kết quả được biểu thị bằng mg đương lượng axit gallic trên gam chất khô (mg GAE / g DM).
1.2.3. Khả năng loại bỏ gốc tự do
Khả năng thu dọn gốc tự do (FRSA) được đo bằng cách sử dụng 2,2-diphenyl-1-picryhydrazyl (DPPH ·) ( Brand-Williams, Cuvelier, & Berset, 1995). Kết quả được biểu thị bằng Trolox tương đương.
1.2.4. Khả năng khử sắt
Khả năng khử ion sắt (FRAP) được đo theo Zhou và cộng sự (2016).
1.3. Nghiên cứu động vật và cân nhắc đạo đức
Tất cả động vật được nuôi ở 25–27°C và được tiếp cận với thức ăn và nước uống. Tất cả các thí nghiệm được thực hiện theo Hướng dẫn của Viện Y tế Quốc gia về Chăm sóc và Sử dụng Động vật Phòng thí nghiệm và Guía para el Cuidado y Uso de los Animales de Laboratorio của ANID. Các quy trình thử nghiệm đã được Ủy ban Đạo đức về Thí nghiệm Động vật của Pontificia Universidad Católica de Chile phê duyệt (Giấy phép số 170914006).
1.4. Thí nghiệm sinh lý
Chuột Sprague-Dawley đực trưởng thành (n = 10) 250–300 g được phân ngẫu nhiên để nhận điều trị chiết xuất bông cải xanh (BE) và đối chứng (CTRL). Nhóm BE nhận được BE trong hai tuần bằng đường uống với liều lượng 3 mg / kg mỗi ngày. Nhóm CTRL (n = 5) nhận được nước muối (0,9% NaCl) bằng thiết bị đo. Các thông số huyết áp (HA), điện tâm đồ (ECG) và huyết động thất trái được đo ở động vật được gây mê (α-chloralose 800 mg / Kg; urethane 40 mg / Kg) trước (CTRL Iso – và BE Iso -) và sau (CTRL Iso + và BE Iso +) gây căng thẳng cho tim khi tiêm isoproterenol vào tĩnh mạch (1 mg / kg). Vào cuối các thí nghiệm, tất cả các con vật đều bị chết vì dùng thuốc mê quá liều (natri pentobarbital 100 mg / kg ip).
1.4.1. Đánh giá chức năng tim
Các thông số tim thất trái (LV) được đo như mô tả trước đây ( Andrade và cộng sự, 2019). Một cách ngắn gọn, một ống thông độ dẫn (Millar, USA) được đặt bên trong động mạch cảnh bên phải để ghi lại tâm thu cơ bản (SBP), tâm trương (DBP), trung bình động mạch (MABP) và áp lực mạch (PP). Sau đó, ống thông được đưa vào LV để thu được thể tích cuối tâm trương (LVEDV), thể tích cuối tâm thu (LVESV), áp lực LVED (LVEDP), thể tích đột quỵ (SV), cung lượng tim (CO), phân suất tống máu (EF) và giá trị lớn nhất và nhỏ nhất của đạo hàm bậc nhất của LVP (tương ứng là dP / dt max và dP / dt min ).
1.4.2. Tỷ lệ rối loạn nhịp tim
Loạn nhịp tim được định nghĩa là nhịp đập sớm hoặc chậm tạo ra sự thay đổi nhịp tim > 2,5 độ lệch chuẩn (SD) so với mức trung bình (Andrade và cộng sự, 2019). Chỉ số loạn nhịp tim được tính toán trong 30 phút trước và sau khi dùng Iso.
1.4.3. Sự thay đổi nhịp tim (HRV)
Cân bằng tự chủ được đánh giá gián tiếp thông qua phân tích HRV. Chuỗi thời gian RR thu được từ các bản ghi cơ sở điện tâm đồ 10 phút được gửi để phân tích miền tần số tự động hồi phục bằng cách sử dụng các tần số cắt sau: tần số thấp (LF; 0,04–0,6 Hz) và tần số cao (HF; 0,6 –2,4 Hz). Tỷ lệ LF / HF được sử dụng như một chỉ số của cân bằng giao cảm tim. LF và HF được biểu thị dưới dạng đơn vị chuẩn hóa (nu). Phân tích HRV được thực hiện trong Kubios Premium phiên bản 3.0.1 (Kubios, Phần Lan).
1.4.4. Phân tích điện tim
Các dạng sóng điện tâm đồ được phân tích từ 15 đến 20 chu kỳ tim bằng plug-in ECG từ phần mềm LabChart 7.0 (ADinstruments, New Zeland).
1.4.5. Phân tích stress oxy hóa tim
Nồng độ Superoxide trong LV được đo bằng cách sử dụng thuốc nhuộm huỳnh quang siêu nhạy cảm với dihydroethidium (DHE). Sinh thiết LV được đông lạnh nhanh được cắt trên một thiết bị đông lạnh có độ dày 50 µm ở -20°C và được đặt trên các lam kính hiển vi tích điện (Superfrost, Hoa Kỳ). Các phần LV được ủ với 1 µM DHE (công nghệ Life, Hoa Kỳ) trong PBS trong 30 phút ở 37°C, và rửa ba lần trong 5 phút trong PBS và được gắn với phương tiện gắn huỳnh quang (Phòng thí nghiệm Vector, Hoa Kỳ). Hình ảnh thu được bằng kính hiển vi tiêu điểm laze (LSM710, Zeiss, Đức). Các trang trình bày được quét (10 trường trên mỗi phần tim, độ phóng đại 20 ×) và hình ảnh được xử lý bằng phần mềm ImageJ (hình ảnh NIH) để ước tính cường độ huỳnh quang.
1.5. Phân tích dữ liệu
Dữ liệu được trình bày dưới dạng trung bình ± SD. Phân tích kiểm định T không ghép đôi và tham số hoặc ANOVA hai chiều theo sau Holm-Sidak post hoc được thực hiện theo cấu trúc dữ liệu. Giá trị p <0,05 được đặt làm mức ý nghĩa thống kê.
2. Các kết quả của thí nghiệm
2.1. Các kết quả

2.1.1. Đặc điểm của chiết xuất bông cải xanh đông khô
Chiết xuất từ các nguồn tự nhiên thường chứa một số hợp chất, tùy thuộc vào dung môi và độ hòa tan của các phân tử. Chiết xuất bông cải xanh được phân tích về hàm lượng SFN và GFN là các hợp chất hoạt tính sinh học được quan tâm, thể hiện hoạt tính chống oxy hóa gián tiếp mà các xét nghiệm in vitro truyền thống không thể phát hiện được. Vì chiết xuất rất có thể chứa các phân tử khác có thể góp phần vào hoạt động chống oxy hóa của nó, chúng tôi đã tiến hành in vitro các xét nghiệm nhằm định lượng các đặc tính chống oxy hóa không thể phân bổ cho SFN và GFN có trong dịch chiết. Bông cải xanh khử nước (trước khi chiết xuất) chứa 0,130 ± 0,002 mg SFN mỗi gam trong khi chiết xuất đông khô chứa 149,1 ± 1,9 mg SFN mỗi gam, thể hiện mức tăng 1,146 lần nồng độ SFN. Sau đó, cung cấp SFN dưới dạng chiết xuất cho phép đạt đến liều điều trị không giống như sử dụng bông cải xanh khử nước, vì lượng 3 mg / kg tương đương với 0,020 g chiết xuất đông khô và 23 g bông cải xanh khử nước.
Hàm lượng glucoraphanin trong dịch chiết đông khô là 0,16 ± 0,01 mg / gam, không đáng kể so với hàm lượng SFN. Kết quả này cho thấy hai thực tế:
- (1) Sự chuyển đổi GFN thành SFN trong quá trình sơ chế bông cải xanh trước khi chiết xuất là gần 100% và do đó chỉ có dấu vết của GFN trong nguyên liệu thực vật trước khi chiết xuất
- (2) bước đầu tiên của quá trình chiết xuất sử dụng dung môi hữu cơ, và độ hòa tan SFN trong dung môi này cao hơn nhiều so với độ hòa tan GFN; do đó chỉ có dấu vết của GFN được phục hồi trong quá trình khai thác ngược.
Có lẽ kết quả của chúng tôi tuân theo sự kết hợp của cả hai hiệu ứng.
Tổng hàm lượng polyphenol (TPC) trong dịch chiết đông khô là 8,8 ± 0,5 mg GAE trên gam. Giá trị này chỉ cao hơn một chút so với giá trị quan sát được đối với bông cải xanh khử nước (5,9 ± 0,09 mg GAE trên gam), cho thấy rằng độ thu hồi của các hợp chất phenolic trong dịch chiết thấp hơn đáng kể so với độ thu hồi SFN. Nguyên nhân là do độ hòa tan của polyphenol trong dung môi hữu cơ thấp. FRAP của chiết xuất đông khô là 5,3 ± 0,1 mg TE trên gam, cao hơn đáng kể so với FRAP được tìm thấy trong bông cải xanh khử nước (1,8 ± 0,2 mg TE trên gam). FRSA của chiết xuất là 2,9 ± 0,04 mg TE trên gam, giống với của bông cải xanh khử nước (2,9 ± 0,2 mg TE trên gam). Hoạt tính chống oxy hóa của chiết xuất thấp hơn đáng kể so với hoạt tính được tìm thấy trong các loại thực phẩm chống oxy hóa được công nhận rộng rãi, chẳng hạn như Berberis microphylla(34,8 ± 1,5 mg TE trên gam trọng lượng khô).
Đặc điểm hóa học của chiết xuất bông cải xanh đông khô chỉ ra rằng hợp chất chính là SFN, với TPC thấp và hoạt tính chống oxy hóa, và do đó các tác dụng sinh lý của việc sử dụng chiết xuất bông cải xanh đông khô có thể là do Sulforaphane.
2.1.2. Ảnh hưởng của việc bổ sung BE đối với các thông số tim mạch cơ bản
Việc bổ sung chiết xuất từ bông cải xanh trong chế độ ăn uống không có tác động tiêu cực / có hại đến sinh lý mạch máu và tim ở động vật khỏe mạnh (Bảng 1). So với các động vật không được điều trị, nhóm được điều trị BE cho thấy các giá trị HATT, HATTr, MABP, PP và HR tương tự nhau (Bảng S1). Ngoài ra, những con chuột được điều trị BE không có thay đổi về kích thước buồng tim so với những con chuột được điều trị bằng CTRL (Bảng 1). Ngoài ra, các đặc tính hoạt động và thụ động của tim cũng tương tự giữa các nhóm (Bảng S1).
Ngược lại, cân bằng tự chủ của tim ở động vật được điều trị BE cho thấy một sự thay đổi đáng kể đối với điều biến phế vị so với chuột không được điều trị (Hình 1 A). Thật vậy, chuột BE cho thấy thành phần LF của HRV giảm so với nhóm CTRL (4,1 ± 4,2 so với 13,4 ± 8,0 nu, BE so với nhóm CTRL, tương ứng) (Hình 1 B) và sự gia tăng đáng kể thành phần HF của HRV (86,5 ± 8,0 so với 95,9 ± 4,2 nu, CTRL so với BE, tương ứng) (Hình 1 C). Theo đó, tỷ lệ LF / HF giảm ở nhóm BE so với nhóm CTRL (Hình 1 D). Tổng công suất HRV cho thấy xu hướng giảm ở động vật BE so với động vật CTRL nhưng điều này không có ý nghĩa thống kê (Bảng S2). Tác dụng tự trị của tim ở nhóm BE không liên quan đến những thay đổi về điện sinh lý tim vì không có thay đổi nào trong ECG lúc nghỉ được tìm thấy ở BE so với động vật CTRL (Bảng S2).
Bảng 1. Ảnh hưởng của chiết xuất bông cải xanh (BE) đến các thông số huyết động của tim.
| CTRL (n = 5) | BE (n = 5) | |
|---|---|---|
| LVESV (µl) | 35,8 ± 6,1 | 50 ± 17,6 |
| LVEDV (µl) | 108,6 ± 30,0 | 142,7 ± 32,3 |
| SV (µl) | 72,8 ± 28,1 | 97,7 ± 18,3 |
| HR (bpm) | 337,2 ± 11,1 | 348,1 ± 24,2 |
| CO (ml min −1 ) | 24,4 ± 8,9 | 32,1 ± 5,8 |
Dữ liệu được trình bày dưới dạng trung bình ± SD CTRL: Kiểm soát; BE: chiết xuất bông cải xanh; LVESV: thể tích cuối tâm thu thất trái; LVEDV: thể tích cuối tâm trương thất trái; SV: Khối lượng đột quỵ; HR: nhịp tim; CO: cung lượng tim. Phân tích kiểm tra T không ghép nối.
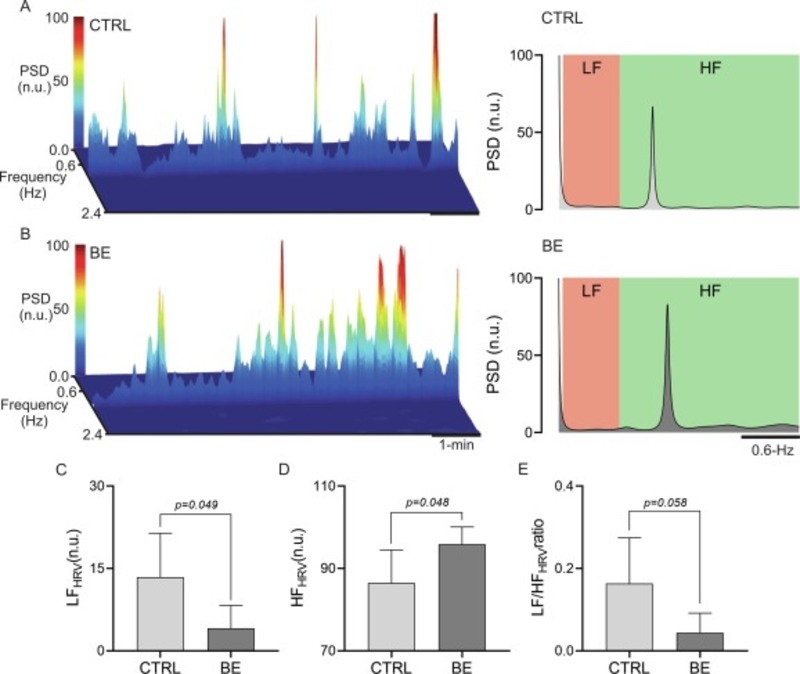
Hình 1. Bổ sung chế độ ăn uống BE làm thay đổi cân bằng tự chủ sang điều hòa phó giao cảm tim. (A) Biểu đồ màu phân tích miền thay đổi theo thời gian đại diện của sự thay đổi nhịp tim (HRV) (trái) và phổ HRV đại diện (phải) trong quá trình ghi cơ bản ở một con chuột CTRL (LF, tần số thấp của HRV; HF, thành phần tần số cao của HRV ). (B) Biểu đồ màu phân tích miền thay đổi theo thời gian đại diện của HRV (trái) và phổ HRV đại diện (phải) trong quá trình ghi cơ bản ở một con chuột được xử lý BE. (C) Dữ liệu tóm tắt thể hiện thành phần LF và HF, và tỷ lệ LF / HF của HRV. Phân tích kiểm tra T không ghép nối . CTRL, n = 5; BE, n = 5.
2.1.3. Bổ sung BE trong chế độ ăn uống làm giảm căng thẳng oxy hóa tim
Căng thẳng oxy hóa tim được đánh giá thông qua định lượng nhuộm DHE trong sinh thiết tim (Hình 2 A và B). So với những con chuột không được điều trị, tim của những con chuột được bổ sung BE trong chế độ ăn uống cho thấy mức độ stress oxy hóa giảm đáng kể (Hình 2 C). Thật vậy, tim từ động vật CTRL hiển thị nhuộm DHE nhiều hơn ~ 25% so với tim từ động vật được xử lý BE (tương ứng là 115,4 ± 2,9 so với 86,7 ± 10,5 au; CTRL so với BE, tương ứng).
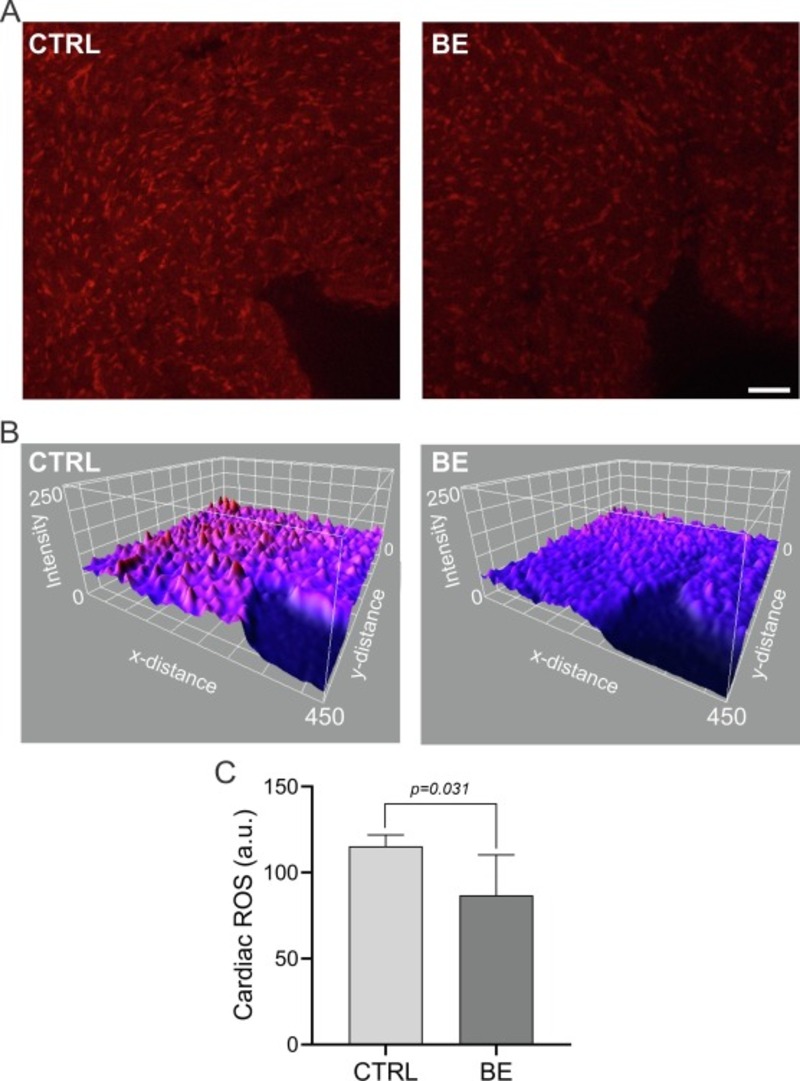
Hình 2. Bổ sung chiết xuất bông cải xanh (BE) trong chế độ ăn uống làm giảm căng thẳng oxy hóa tim. (A) Hình ảnh đại diện của sự hình thành ROS được xác định bằng phương pháp nhuộm dihydroethidium (DHE) (độ phóng đại 20x). Lưu ý rằng chuột được xử lý BE cho thấy sự nhuộm DHE giảm so với nhóm CTRL. Thanh chia độ, 50 μm. (B) Biểu đồ cường độ huỳnh quang DHE đại diện từ một con chuột CTRL và một con chuột BE. (C) Dữ liệu tóm tắt cho thấy tác động của việc bổ sung BE đối với sự hình thành ROS của mô tim theo đơn vị tùy ý (au). Phân tích kiểm tra T không ghép nối . CTRL, n = 5; BE, n = 5.
2.1.4. Tác dụng bảo vệ của BE trong căng thẳng tim cấp tính
Cả hai nhóm đều cho thấy tỷ lệ rối loạn nhịp tim tương tự nhau trong quá trình ghi chép ban đầu (12,0 ± 9,9 so với 9,0 ± 9,6 sự kiện / giờ, CTRL so với nhóm BE, tương ứng, p> 0,05) (Hình 3 A và B). Tuy nhiên, bổ sung chiết xuất bông cải xanh trong chế độ ăn uống trong hai tuần sẽ bảo vệ đáng kể tim khỏi rối loạn nhịp tim cấp tính do căng thẳng.
Thật vậy, động vật CTRL cho thấy chỉ số rối loạn nhịp tim tăng ~ 3 lần sau khi kích thích Iso cấp tính (38,4 ± 19,6 so với 12,0 ± 9,9 sự kiện / giờ, CTRL Iso + so với CTRL Iso- , p <0,05) và phản ứng này là không còn xuất hiện ở những con chuột được điều trị BE trước khi dùng Iso (4,0 ± 3,2 so với 8,9 ± 9,9 sự kiện / giờ, BE Iso + so với BE Iso-, tương ứng; p> 0,05). Điều quan trọng là, chiết xuất bông cải xanh không làm thay đổi phản ứng chronotropic của tim hoặc ionotropic đối với kích thích β-adrenergic, sau đó không ảnh hưởng đến chức năng tim ( Hình 3 và Bảng S2 ).
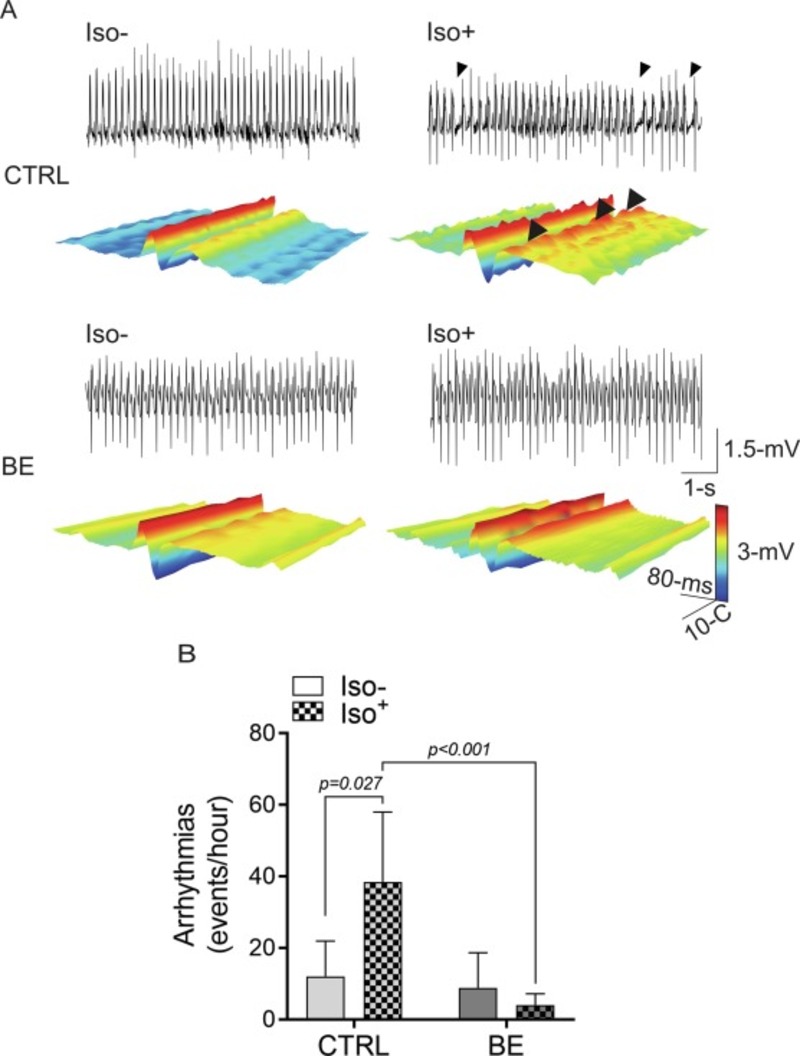
Hình 3. Điều trị bằng miệng với chiết xuất từ bông cải xanh giúp tim tránh khỏi tình trạng rối loạn nhịp tim do căng thẳng tim. (A) Bản ghi đại diện của điện tâm đồ (ECG) và biểu đồ thác nước của các sóng ECG liên tục cho một chuột CTRL (lên) và chuột được điều trị BE (dưới) trước và sau khi gây căng thẳng tim do isoproterenol (Iso). Các đầu mũi tên cho thấy sự hiện diện của các sự kiện loạn nhịp tim; (B) Dữ liệu tóm tắt cho thấy tỷ lệ rối loạn nhịp tim trong Iso. Hai-Way ANOVA tiếp theo là Holm Sidak post hoc. CTRL, n = 5; BE, n = 5.
3. Kết luận
Chế độ ăn uống bổ sung BE giàu SFN sẽ giúp bảo vệ tim trong thời kỳ căng thẳng tim cấp tính bằng cách hạn chế tỷ lệ rối loạn nhịp tim. Quan trọng là, tác dụng bảo vệ BE diễn ra mà không ảnh hưởng đến chức năng tim. Cuối cùng, BE cũng chuyển HRV theo hướng điều biến phó giao cảm, cho thấy rằng việc bổ sung BE có thể giúp cải thiện sức khỏe tim mạch bằng cách dỡ bỏ hệ thần kinh giao cảm.
4. Các chủ đề liên quan
Dưới đây là một số bài viết về các chủ đề nghiên cứu có liên quan đến hoạt chất Sulforaphane và công dụng của chúng:
- Sulforaphane : Một sản phẩm tự nhiên chống lại các loại oxy phản ứng
- Sulforaphane cải thiện ethanol cộng với xơ gan
- Sulforaphane cải thiện sự trao đổi chất của bệnh nhân mắc chứng run/thất điều liên quan NST X dễ gãy (FXTAS)
5. Tham vấn chuyên môn
- Bác sĩ
- Nguồn tham khảo: https://www.sciencedirect.com/science/article/pii/S1756464620304916

