- Tổng quan
- 1. Vật liệu và phương pháp
- 1.1. Vấn đề về đạo đức
- 1.2. Nuôi cấy tế bào nội mô tĩnh mạch rốn người
- 1.3. Dấu hiệu kích hoạt tế bào nội mô
- 1.4. Sản xuất endothelin-1 và 8-isoprostane bởi HUVECs
- 1.5. Tính thấm của tế bào nội mô
- 1.6. Phương pháp nuôi cấy nhau thai
- 1.7. Nuôi cấy nguyên bào nuôi cấy tế bào lông nhung nhau thai
- 1.8. Chuyển nạp RNA can thiệp nhỏ
- 1.9. Thử nghiệm
- 1.10. Chiết xuất protein
- 1.11. Western blot
- 1.12. Phân tích thống kê
- 2 Kết quả của thí nghiệm
- 2.1. Sulforaphane làm tăng mức protein NRF2, chuyển vị hạt nhân NRF2 và mức protein HO-1 trong HUVECs
- 2.2. Sulforaphane cải thiện rối loạn chức năng tế bào nội mô trong ống nghiệm
- 2.3. Nrf2 hạ gục đã chặn một số tác dụng tế bào nội mô của sulforaphane
- 2.4. Sulforaphane làm thay đổi mẫu nhau thai và nguyên bào nuôi cô lập bài tiết các hợp chất hoạt mạch
- 3. Kết luận
- 4. Các chủ đề liên quan
- 5. Tham vấn chuyên môn
Stress oxy hóa nhau thai có thể được cải thiện và giảm bớt bằng Sulforaphane hay không? Cơ chế hoạt động của Sulforaphane trong quá trình đó như thế nào?
Tổng quan
Đặc điểm rối loạn chức năng nội mô ở người mẹ của tiền sản giật một phần là do nhau thai sản xuất quá nhiều các yếu tố chống tạo mạch, bao gồm Flt-1 hòa tan, endoglin hòa tan và activin A, gây ra stress oxy hóa nhau thai. Nhóm nghiên cứu đã đánh giá xem liệu chất chống oxy hóa và chất kích hoạt NRF2 sulforaphane có thể giảm thiểu rối loạn chức năng nội mô và nguyên bào nuôi trong ống nghiệm hay không.
Các nhà nghiên cứu sẽ gây ra sự rối loạn chức năng tế bào nội mô tĩnh mạch rốn người (HUVECs) bằng TNF-α, đánh giá sự hoạt hóa và rối loạn chức năng nội mô (endothelin-1, phân tử kết dính tế bào mạch máu; VCAM1, phân tử kết dính nội bào; ICAM1, e-selectin và tính thấm nội mô) trong sự hiện diện hay không có sulforaphane. Họ cũng đánh giá tác dụng của sulforaphane trong việc giảm thiểu tổn thương do thiếu oxy và tăng oxy ở mẫu nhau thai đủ tháng bằng cách đo sự tiết các yếu tố chống tạo mạch.
Để đánh giá vai trò của NRF2, các nhà nghiên cứu đã làm im lặng NRF2 trong HUVEC và các tế bào nguyên bào nuôi sơ cấp. Kết quả cho thấy Sulforaphane có thể làm giảm sự bài tiết HUVEC qua trung gian TNF-α của endothelin-1, VCAM1, ICAM1 và E-selectin, và ngăn chặn sự gia tăng tính thấm của nội mô. Trong mẫu cấy nhau thai, sulforaphane làm giảm sự bài tiết Flt-1 hòa tan, endoglin hòa tan và activin A. Sulforaphane gây ra sự hoạt hóa và chuyển vị hạt nhân của NRF2 trong HUVEC, tạo ra heme oxygenase 1. Sự im lặng của NRF2 chặn một số nhưng không phải tất cả các tác dụng của sulforaphane trong HUVECs. Sự im lặng của NRF2 không ngăn được sự ức chế của sulforaphane đối với sự bài tiết Flt-1 hoặc activin A. hòa tan của sulforaphane Chính vì thế, trong việc giảm stress oxy hóa ở nhau thai và nội mô, sulforaphane có thể cung cấp một phương pháp điều trị bổ trợ mới để điều trị tiền sản giật.
1. Vật liệu và phương pháp
1.1. Vấn đề về đạo đức

Ủy ban Đạo đức Nghiên cứu Con người của Monash Health đã phê duyệt việc thu thập nhau thai, dây rốn và huyết thanh và có sự đồng ý bằng văn bản được thông báo từ mỗi bệnh nhân trước khi thu thập. Tế bào nội mô tĩnh mạch rốn ở người (HUVEC) và nuôi cấy tế bào gốc và tế bào tế bào lông nhung được thu thập tại thời điểm mổ lấy thai.
Tiêu chuẩn để loại trừ là: hút thuốc, lạm dụng rượu và ma túy, đa thai, <38 tuần, BMI> 35, tăng huyết áp từ trước, bệnh thận, đái tháo đường, rối loạn chức năng tuyến giáp, hội chứng chuyển hóa hoặc tiền sản giật trong lần mang thai trước. Loại trừ đã được thực hiện đối với các loại thuốc sau đây; thuốc hạ huyết áp, aspirin, thuốc chống viêm không steroid hoặc thuốc tuyến giáp. Huyết thanh được lấy từ những phụ nữ được chẩn đoán là TSG theo hướng dẫn của SOMANZ ngay trước khi sinh.
1.2. Nuôi cấy tế bào nội mô tĩnh mạch rốn người
HUVECs được phân lập từ dây rốn thu thập từ thai đủ tháng khỏe mạnh (n = 5 – 7) tại thời điểm sinh mổ, như đã mô tả trước đây. Tóm lại, các tế bào được nuôi cấy trong môi trường M199 (Gibco-BRL), 10% huyết thanh thai nhi (FCS), các yếu tố tăng trưởng biểu bì và nguyên bào sợi (10 ng / ml), heparin (90ug / ml), 1% streptomycin sulphat (100 μg / ml) và amphotericin B (0,25 μg / ml; Invitrogen). Các bình được phủ 0,2% gelatin trước khi gieo hạt bằng các HUVEC đã phân lập. Tế bào được ủ và mở rộng trong 5% CO2, 70% N2 và 25% O2 ở 37 ° C với các mẫu cấy để làm thí nghiệm lấy từ đoạn thứ hai và thứ ba.
1.3. Dấu hiệu kích hoạt tế bào nội mô
Các dấu hiệu kích hoạt tế bào nội mô được định lượng trong HUVECs được xử lý bằng sulforaphane (Sigma-Aldrich, St. Louis, MO, S6317-5MG; 5 μM, 10 μM, 20 μM) và / hoặc TNFα (1 ng / ml, Thermo Fisher Scientific PHC3015) trong 24 giờ, thông qua phương pháp đo tế bào dòng chảy, được biểu thị bằng chỉ số dòng chảy trung bình (MFI). Tóm lại, các HUVEC được cạo một cách cơ học từ bình của chúng trước khi nhuộm với một trong các kháng thể sau, với các từ đồng nghĩa, độ pha loãng kháng thể và số danh mục được hiển thị trong ngoặc đơn: CD54-Pacific Blue (phân tử kết dính nội bào; ICAM1, 1: 100, 353109), CD106 -PE (phân tử kết dính tế bào mạch máu; VCAM1, 1:50, 305805) CD62E-APC (E-selectin, 1: 100, 336011) và nhuộm được so sánh với các đối chứng isotype thích hợp của chúng. Các kháng thể và đối chứng isotype được lấy từ Biolegend (San Diego, CA). HUVEC được ủ trên đá với kháng thể hoặc đối chứng isotype trong 20 phút trước khi rửa và cố định trong 1% paraformaldehyde trong đệm FACS. Các dấu hiệu kích hoạt tế bào nội mô sau đó được phân tích trên BD FACS Canto II (BD Biosciences, San Jose, CA). Phân tích được thực hiện bằng phần mềm phân tích tế bào FlowJo (Tree Star, Oakland, OR).
1.4. Sản xuất endothelin-1 và 8-isoprostane bởi HUVECs
Mức endothelin-1 (ET-1) được xác định trong phần nổi của HUVECs được xử lý bằng sulforaphane (Sigma-Aldrich, St. Louis, MO, S6317-5MG; 5 μM, 10 μM, 20 μM) và / hoặc TNFα (1 ng / ml) trong 24 giờ qua ELISA (DET100, hệ thống R&D, Minneapolis, MN). Mức 8-isoprostane, một dấu hiệu của stress oxy hóa, được đo trong cùng dịch nuôi cấy bằng phương pháp xét nghiệm miễn dịch enzym (Caymen Chemicals, Ann Arbor, MI). Tất cả các thử nghiệm được thực hiện theo hướng dẫn của nhà sản xuất.
1.5. Tính thấm của tế bào nội mô
Tính toàn vẹn của lớp đơn lớp tế bào nội mô sau khi xử lý TNFα được đánh giá thông qua xét nghiệm tính thấm dựa trên FITC-dextran. HUVECs được mạ trong tấm chèn xuyên sáng polycarbonate được hồ hóa (Corning, Oneonta, NY; 0,4 μM, 6,5 mm, tấm 24 giếng) với mật độ 50.000 tế bào chèn và được ủ ở 37 ° C trong 3 ngày để tạo thành một lớp đơn lớp. Sau đó, các tế bào được xử lý bằng TNFα tái tổ hợp ở liều tối ưu (100 ng / ml) khi có hoặc không có sulforaphane (20 μM) trong 24 giờ.
Vào cuối giai đoạn xử lý, môi trường nuôi cấy được lấy ra khỏi cả ngăn trên và ngăn dưới, và 1 mg / ml FITC-dextran (Sigma-Aldrich; 40.000 MW) trong môi trường nuôi cấy được thêm vào ngăn trên, trong khi môi trường nuôi cấy tươi đã được thêm vào buồng dưới. Sau đó, các tế bào được ủ trong 1 giờ ở 37 ° C. Môi trường được lấy ra khỏi ngăn dưới và pha loãng 1:20 với PBS trong một đĩa 96 giếng có vách đen trước khi thu được các số đọc huỳnh quang ở kích thích 485 nm và phát xạ 535 nm.
Tính thấm của tế bào nội mô sau khi điều trị bằng huyết thanh của phụ nữ bị tiền sản giật (5% huyết thanh trong M199 Medium được bổ sung với 1% kháng sinh và 1% L-Glutamine) được đo bằng cách sử dụng bộ xét nghiệm tính thấm thành mạch 24 giếng in vitro (Merck Millipore, Billerica, MA ). Thử nghiệm được thực hiện theo hướng dẫn của nhà sản xuất. Tế bào nội mô được xử lý bằng huyết thanh từ thai kỳ phù hợp với phụ nữ mang thai khỏe mạnh được sử dụng làm đối chứng.
1.6. Phương pháp nuôi cấy nhau thai

Ngay sau khi thu thập, một số cá tuyết được tách ra khỏi nhau thai và rửa trong 1x Dung dịch muối cân bằng Hank (HBSS) ướp lạnh để loại bỏ máu. Các mẫu được nhúng ngập trong 1x HBSS trong đĩa petri trong khi mô lông nhung được tách nhẹ ra khỏi mô liên kết chính và hệ mạch. Sau đó, mẫu lông nhung nhau thai (50 mg) được nuôi cấy trên đĩa 6 giếng với Phương tiện 199 (Life Technologies, Carlsbad, CA) được bổ sung 1% Antibiotics (Life Technologies) A.G. Cox, et al. Tăng huyết áp khi mang thai 16 (2019) 1–10 2 và 1% L-Glutamine (Life Technologies).
Một nhóm mẫu nhau thai (n = 6) được xử lý bằng xanthine / xanthine oxidase (X / XO) (Sigma-Aldrich; 2,3 mM X và 15 mU / ml XO), để gây ra stress oxy hóa nhau thai, khi có hoặc không có sulforaphane (5 μM, 10 μM và 20 μM). Các mẫu cấy nhau thai chỉ được xử lý bằng môi trường được sử dụng làm đối chứng âm tính. Các mẫu này được nuôi cấy trong 5% O2 ở 37 ° C trong 24 giờ. Một nhóm mẫu nhau thai khác (n = 6) được tiếp xúc với 1% O2 khi có hoặc không có sulforaphane (5 μM, 10 μM và 20 μM) ở 37 ° C trong 24 giờ. Mẫu cấy nhau thai tiếp xúc với 5% O2 được sử dụng làm đối chứng âm tính. Sau 24 giờ ủ, môi trường nuôi cấy được lấy ra và bảo quản ở −80 ° C với 0,005% hydroxytoluene được butyl hóa (BHT, Sigma-aldrich, St. Louis, MO; W218405) để ngăn chặn sự hình thành và phân hủy gốc của 8-isoprostane.
1.7. Nuôi cấy nguyên bào nuôi cấy tế bào lông nhung nhau thai
Cotelydons được cắt bỏ ngẫu nhiên từ nhau thai (n = 6), tấm nền được loại bỏ và rửa mẫu trong nước đá lạnh 1x HBBS để loại bỏ máu còn sót lại và khuyến khích phân đoạn lông nhung. Các mẫu được đặt trong đĩa petri và ngập trong 1x HBSS. Villi (20–25 g) được tách ra khỏi mạch và tiếp xúc với ba lần tiêu hóa trong DMEM có hàm lượng glucose thấp (Công nghệ cuộc sống; 316000083) với 7,5 ml 2,5% trypsin (Công nghệ cuộc sống; 15090046), 0,19 g Chất thải loại II (Công nghệ cuộc sống; 17105–041) và 150uL bò DNase I Grade II (Sigma-Aldrich; 10104159001) trong 15 phút trong nồi cách thủy 37 ° C.
Giữa mỗi lần phân hủy dịch nổi được thu thập, lọc qua bộ lọc tế bào và giữ ở nhiệt độ phòng cho đến khi hoàn thành tất cả các quá trình ủ. Các mẫu được ly tâm ở 350 g, 4 ° C trong 5 phút, loại bỏ phần nổi phía trên và viên nén được tiếp tục trong môi trường nguyên bào nuôi hoàn chỉnh (DMEM / F12 Life Technologies; 11330-057, 1% antimycotic-architects Life Technologies 15; 140-122 và Life Công nghệ; 15240-062). Tách gradient Percoll (5–70% GE Healthcare; 17-0891-01) được sử dụng với ly tâm ở 1200 g, 4 ° C trong 20 phút để cô lập một lớp tế bào tế bào lông nhung. Chúng được pha loãng trong môi trường nguyên bào nuôi hoàn chỉnh và được mạ ở 0,7 triệu tế bào mỗi giếng trên đĩa 24 giếng.
Tất cả các mẫu được ủ ở 37 ° C trong oxy 8% trong 24 giờ để khuyến khích sự kết dính và tăng sinh. Các mẫu được chia ngẫu nhiên thành hai nhóm điều trị. X / XO đầu tiên (2,3 mM X và 15 mU / m XO) khi có hoặc không có sulforapahane (20 μM) trong 8% oxy. Nhóm thứ hai được đặt trong ôxy 1% có hoặc không có sulforaphane (20 μM). Đối chứng âm tính hoặc đã nhận sulforaphane hoặc không và không trải qua điều trị. Các mẫu được ủ ở 37 ° C trong tủ ấm oxy tương ứng của chúng trong 24 giờ nữa
1.8. Chuyển nạp RNA can thiệp nhỏ
HUVEC và mẫu nhau thai được truyền ngược với RNA can thiệp nhỏ sợi đơn (siRNA) hướng tới NRF2, trình tự xáo trộn (kiểm soát âm tính) hoặc GAPDH (kiểm soát dương tính) với việc sử dụng Thuốc thử Lipofectamine RNAimax (tất cả từ Life Technologies, Carlsbad, CA), theo hướng dẫn của nhà sản xuất. Tất cả các thí nghiệm được hoàn thành trong vòng 4 ngày kể từ ngày chuyển giao như mô tả bên dưới. Các mẫu được đưa trở lại ôxy 8%, 37 ° C và được ủ thêm 24 giờ.
1.9. Thử nghiệm
ELISA thương mại được sử dụng theo hướng dẫn của nhà sản xuất. Mức độ của sFlt-1 (Hệ thống R&D, Minneapolis, Độ pha loãng Human VEGF R1 / Flt1 DVR100B: 1:25) và sEng (Hệ thống R&D, Độ pha loãng Minneapolis Human Endoglin / CD105 DNDG00: gọn gàng) được thử nghiệm trong phần nổi của các mẫu thiếu oxy trong khi nồng độ 8-isoprostane (Cayman, Ann Arbor, 8-isoprostane 516,351 độ pha loãng 1:50) và activin A (Hệ thống R&D, độ pha loãng Minneapolis DAC00B: 1: 2) được đánh giá trong phần nổi phía trên của các mẫu được xử lý X / XO.
1.10. Chiết xuất protein
HUVEC và chất nổi trên nhau thai được thu thập và bảo quản ở -80 ° C với 0,005% BHT (Sigma-Aldrich) để ngăn chặn sự hình thành và phân hủy gốc của 8-isoprostane. Protein được chiết xuất bằng cách sử dụng phương pháp cạo tế bào vật lý với sự hiện diện của đệm ly giải (sản xuất trong nhà) và chất ức chế protease (Sigma-Aldrich; 11697498001). Ly tâm được sử dụng để tách các mảnh vụn tế bào và phần nổi trên kết quả được bảo quản ở -80 ° C trước khi phân tích với Western blot.
1.11. Western blot
Các mẫu cấy HUVEC được đánh giá về sự hoạt hóa NRF2 và phản ứng chống oxy hóa bằng cách xác định sự chuyển vị NRF2 trong hạt nhân và mức độ protein HO-1. Xác nhận đánh sập siRNA cũng được thực hiện bằng cách sử dụng Western blot cho HO-1. Các phân đoạn hạt nhân và tế bào chất được phân lập bằng cách sử dụng thuốc thử NE-PER (Thermofisher). Mức độ protein được định lượng bằng cách sử dụng BCA. Western blots đã được thực hiện như đã mô tả trước đây. Các màng được chặn bằng sữa tách béo 5% trong 1 x HBBS với 0,1% Tween-20 trong 1 giờ trước khi khảo sát bằng kháng thể. Kháng thể chính HO-1 (ab52947, 1: 2000, Abcam) được pha loãng trong đệm chặn và ủ ở 4 ° C qua đêm. Các màng được ủ trong kháng thể thứ cấp chống thỏ (sc-2004, 1: 10000, Abcam) với đệm chặn trong một giờ ở nhiệt độ phòng, trước khi tạo hình (biorad ChemiDoc, chất nền Western ECL, 170–5060). Màng sau đó được rửa sạch và ủ trong kháng thể beta actin sơ cấp đối với các phân đoạn tế bào (sc-47778, 1: 5000, Abcam) hoặc HDAC1 đối với các phân đoạn hạt nhân (ab7028, 1: 2000, Abcam) và chống chuột thứ cấp (sc-2005, 1 : 20000, Abcam) mỗi lần trong một giờ ở nhiệt độ phòng.
1.12. Phân tích thống kê
Các phân tích thống kê được thực hiện bằng ANOVA một chiều, sau đó là nhiều phép so sánh với bài kiểm tra Tukey post-hoc. Các nhóm được coi là khác biệt có ý nghĩa nếu P <0,05. Tất cả dữ liệu được phân tích bằng GraphPad Prism 7.0 (GraphPad Software, La Jolla, CA).
2 Kết quả của thí nghiệm
2.1. Sulforaphane làm tăng mức protein NRF2, chuyển vị hạt nhân NRF2 và mức protein HO-1 trong HUVECs
Xử lý HUVECs bằng TNF-α không tạo ra chuyển vị hạt nhân NRF2 (Hình 1A) hoặc tổng số NRF2 (Hình 1B). Xử lý HUVECs bằng sulforaphane làm tăng chuyển vị hạt nhân của NRF2 gấp 3 lần với mức tăng tương ứng 4 lần trong tổng số NRF2, so với HUVECs không được điều trị và TNF-α được xử lý đơn thuần (Hình 1A & C; p <0,01, Hình 1B & C ; p <0,0001). Điều này có liên quan đến sự gia tăng gần 4 lần mức protein HO1 so với chỉ điều trị TNF-α (Hình 1D p = 0,04), được xác nhận bởi Western blot (Hình 1E).
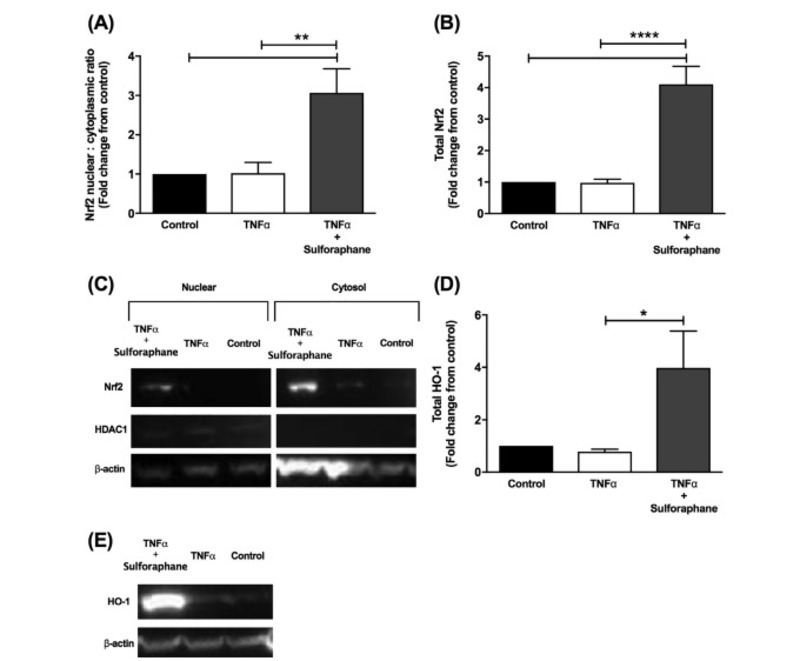
Hình 1. Biểu hiện protein Nrf2 và HO-1 trong HUVECs được xử lý bằng sulforaphane. (A) Chuyển vị hạt nhân Nrf2 và (B) biểu hiện tổng số protein Nrf2 được đo 6 giờ sau khi HUVECs chỉ được xử lý bằng môi trường, TNF-α (100 ng / ml) hoặc TNF-α với 20 μM sulforaphane. (C) Hình ảnh vệt phía tây đại diện cho Nrf2 được hiển thị với khoảng trắng cho biết các làn đường không liền nhau từ cùng một khối. (D) Tổng biểu hiện HO-1 được đo trong 24 giờ sau khi điều trị và hình ảnh đại diện Western blot (E). Dữ liệu được biểu thị bằng giá trị trung bình ± SEM. * P <0,05, ** P <0,01, **** P <0,0001. n = 6 dòng tế bào từ những người cho nhau thai độc lập.
2.2. Sulforaphane cải thiện rối loạn chức năng tế bào nội mô trong ống nghiệm
Xử lý HUVECs với TNFα làm tăng đáng kể sự biểu hiện của ICAM1, VCAM1 và E-selectin (P <0,001; Hình 2A – C). Những tác dụng này được giảm nhẹ bởi sulforaphane theo cách phụ thuộc vào liều lượng (Hình. 2A – C; p <0,01). Xử lý TNF-α của HUVECs cũng làm tăng biểu hiện của ET-1 (p = 0,004). Chỉ liều sulforaphane cao nhất (20 μM) mới giảm thiểu đáng kể tác dụng này (Hình 2D, p = 0,04). Ở 20 μM sulforaphane cũng làm giảm nồng độ cả TNF-α và huyết thanh tiền mô được kích thích làm tăng tính thấm đơn lớp của tế bào nội mô (Hình 2E; p = 0,001 & Hình 2F; p = 0,04, được biểu thị bằng sự thay đổi lần so với đối chứng).
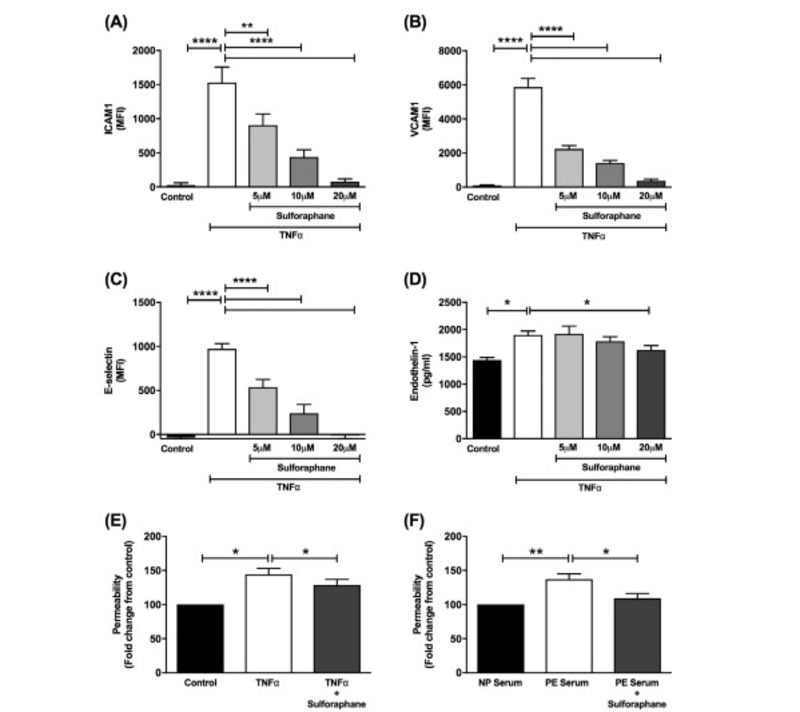
Hình 2. Hiệu quả của điều trị bằng sulforaphane đối với các dấu hiệu của rối loạn chức năng nội mô trong ống nghiệm. Sự biểu hiện của (A) ICAM1, (B) VCAM1 và (C) E-selectin đo được 6 giờ sau khi HUVECs được xử lý chỉ bằng một trong hai phương tiện, TNF-α (quảng cáo số liệu 1 ng / ml hoặc số liệu 100 ng / ml ef) hoặc TNF -α với 3 liều sulforaphane khác nhau (5 μM, 10 μM, 20 μM) được đo bằng phương pháp đo tế bào dòng chảy. Mức độ protein của (D) endothelin-1 trong dịch nuôi cấy được thu thập 24 giờ sau khi xử lý được đo bằng ELISA. (E) Tính thấm FITC-dextran qua các đơn lớp HUVEC chỉ được xử lý bằng môi trường, TNF-α (100 ng / ml) hoặc TNF-α và 20 μM sulforaphane sau 24 giờ xử lý, được biểu thị bằng sự thay đổi lần so với đối chứng. (F) Tính thấm FITC-dextran trong đơn lớp HUVEC 24 giờ sau khi điều trị bằng huyết thanh của phụ nữ mang thai bình thường (huyết thanh NP), với huyết thanh của phụ nữ bị tiền sản (huyết thanh PE) hoặc với huyết thanh PE và 20 μM sulforaphane, được biểu thị bằng sự thay đổi lần so với đối chứng . Dữ liệu được biểu thị bằng giá trị trung bình ± SEM. * P <0,05, ** P <0,01, **** P <0,0001. n = 5–7 dòng tế bào từ những người cho nhau thai độc lập.
2.3. Nrf2 hạ gục đã chặn một số tác dụng tế bào nội mô của sulforaphane
Để xác định sự tham gia của NRF2 như một chất trung gian của sulforaphane đối với chức năng nội mô trong ống nghiệm, các nhà nghiên cứu đã làm im lặng NRF2 bằng siRNA. Khi có mặt NRF2 làm im lặng sulforaphane không làm tăng HO-1 trong HUVECs (Hình 3A & B) cũng không ngăn cản TNF-α gây tăng tính thấm đơn lớp nội mô (Hình 3C, được biểu thị bằng sự thay đổi nếp gấp so với đối chứng). Sự im lặng của NRF2 ngăn cản sự gia tăng TNF-α gây ra trong ICAM-1 (Hình 3D) nhưng nó không ngăn chặn sự giảm thiểu của sulforaphane đối với cảm ứng TNFα của VCAM-1 và E-selectin (Hình 3E & 3F tương ứng; tất cả p <0,05) . NRF2 im lặng đã chặn sự gia tăng TNF-α gây ra trong ET1 và chất đánh dấu ứng suất oxy hóa 8-isoprostane, ngăn ngừa bất kỳ tổn thương nào và do đó bất kỳ đánh giá nào về sulforaphane (Hình 3G & H tương ứng).
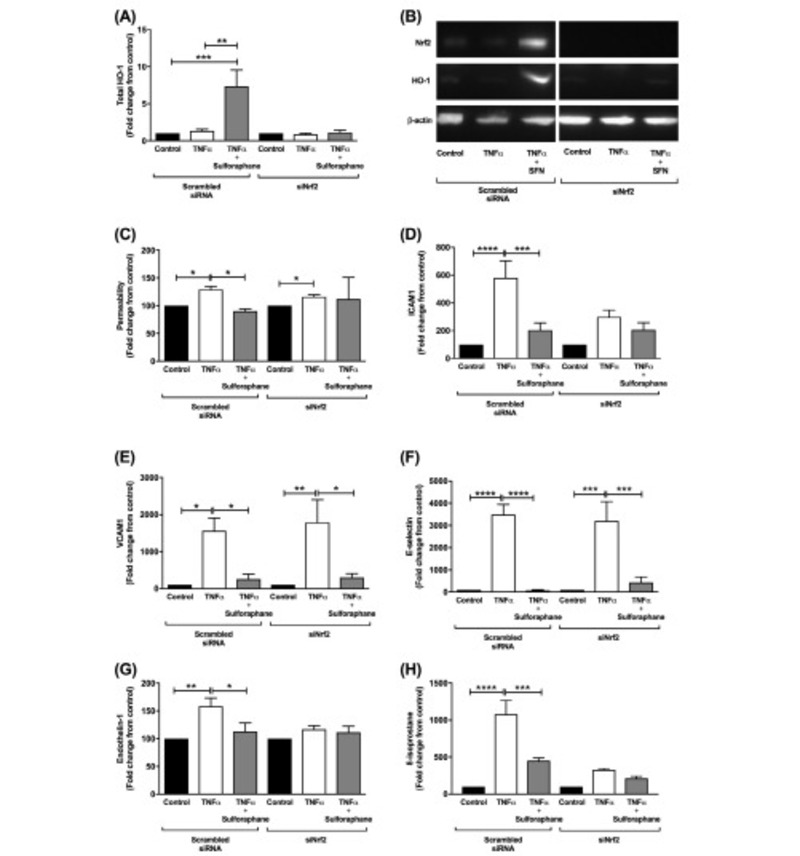
Hình 3. Nrf2 hạ gục. HUVEC được truyền bằng RNA can thiệp nhỏ hướng tới Nrf2 (siNrf2) và chỉ được xử lý bằng một trong hai môi trường, chỉ TNF-α (1 ng / ml hình a, b, df và 100 ng / ml hình c) hoặc TNF-α với 20 μM sulforaphane. Các HUVEC được truyền bằng RNA can thiệp nhỏ có chứa một trình tự xáo trộn (xáo trộn siRNA) và sau đó tiếp xúc với các phương pháp xử lý được sử dụng làm đối chứng. (A) Tổng số biểu hiện protein HO-1 trong HUVECs 24 giờ sau khi điều trị được đo bằng phương pháp Western blot. (B) Hình ảnh đại diện cho HO-1 western blot. Ngoài ra, sau 24 giờ tính thấm FITC-dextran mặc dù (C) HUVEC đơn lớp được đo, được biểu thị bằng sự thay đổi nếp gấp so với đối chứng. Sự biểu hiện của (D) ICAM1, (E) VCAM1 và (F) E-selectin được đo 6 giờ sau khi xử lý bằng phương pháp đo tế bào dòng chảy. Mức độ (G) endothelin-1 và (H) 8-isoprostane trong dịch nuôi cấy HUVEC được đo tương ứng 24 giờ sau khi xử lý bằng ELISA và EIA. Dữ liệu được biểu thị bằng giá trị trung bình ± SEM. * P <0,05, ** P <0,01, *** P <0,001, **** P <0,0001. n = 5–6 dòng tế bào từ những người cho nhau thai độc lập.
2.4. Sulforaphane làm thay đổi mẫu nhau thai và nguyên bào nuôi cô lập bài tiết các hợp chất hoạt mạch
Sau đó, các nhà nghiên cứu tìm cách đánh giá tác động của sulforaphane đối với sự bài tiết của nhau thai đối với các hợp chất hoạt tính sFlt-1 và sEng hòa tan sau tổn thương do thiếu oxy (1% O2). Cả hai hợp chất này đều tăng cao trong huyết thanh của phụ nữ bị tiền sản và có liên quan đến rối loạn chức năng nội mô làm cơ sở cho sự tiến triển của bệnh. Nuôi cấy mẫu nhau thai trong 1% O2 làm tăng đáng kể sFlt-1 (p = 0,04) và sEng, (p = 0,005) bài tiết (Hình 4A và 4B), một hiệu ứng được ngăn chặn bởi sulforaphane ở 20 μM, nhưng không ở nồng độ thấp hơn (sFlt -1: Hình 4A, p = 0,047) và (sEng: Hình 4B, p = 0,02).
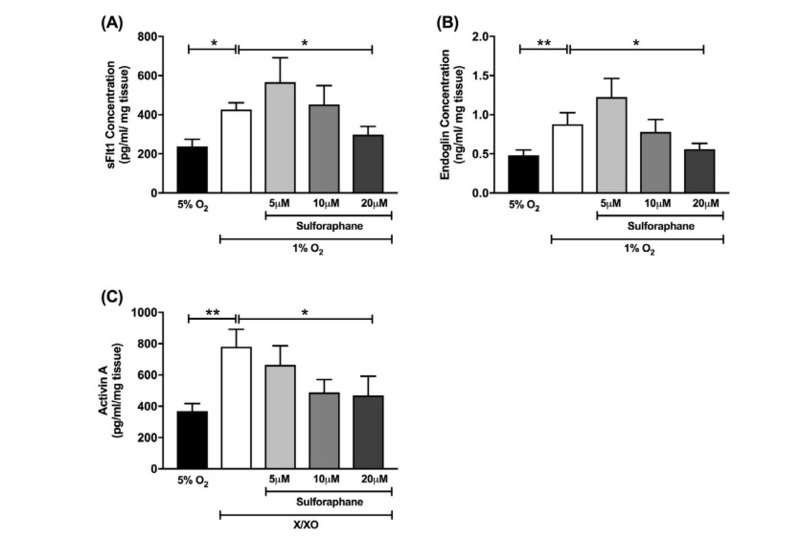
Hình 4. Ảnh hưởng của việc xử lý bằng sulforaphane trên mẫu nhau thai nuôi cấy trong ống nghiệm. Chất nổ được ủ trong 24 giờ trong 5% oxy 37 ° c trong môi trường chỉ hoặc môi trường có dung dịch X / XO, hoặc trong 1% oxy 37 ° c trong 24 giờ, có hoặc không có sulforaphane (5 μM, 10 μM và 20 μM). Mức độ (A) sFlt-1 và (B) sEng được định lượng bằng cách sử dụng ELISA từ môi trường nuôi cấy của các mẫu thiếu oxy sau 24 giờ xử lý. (C) Mức độ activin A được định lượng bằng cách sử dụng ELISA từ môi trường nuôi cấy của các mẫu được xử lý X / XO sau 24 giờ xử lý. Dữ liệu được biểu thị bằng giá trị trung bình ± SEM. * P <0,05, ** P <0,01, **** P <0,0001. n = 6 mẫu từ các nhà tài trợ nhau thai độc lập.
Bắt chước tổn thương oxy hóa, sự tiếp xúc của mẫu nhau thai với X / XO làm tăng đáng kể sự bài tiết activin A (p = 0,004), một hiệu ứng được giảm thiểu khi điều trị bằng sulforaphane ở nồng độ 10 μM và 20 μM (Hình 4C p = 0,03, p = 0,047).
Sau đó, nghiên cứu sử dụng các nguyên bào tế bào lông nhung cô lập để khám phá tác dụng của sulforaphane trong việc cải thiện sản xuất sFlt-1, sEng, activin A và 8-isporostane. Việc ủ trong 1% O2 không làm tăng đáng kể việc sản xuất sFlt-1 (Hình 5A) hoặc sEng (Hình 5B) của nguyên bào nuôi. Tuy nhiên, sử dụng sulforaphane (20 μM) làm giảm đáng kể bài tiết sFlt-1, so với đối chứng không độc (p = 0,0006) và nuôi cấy thiếu oxy (p = 0,0003).
Không có tác dụng của sulforaphane đối với sự bài tiết sEng (p = 1,0). Xử lý các nguyên bào nuôi tách biệt với X / XO làm tăng đáng kể sự bài tiết của cả activin A (p = 0,006) và 8-isoprostane (p = 0,009). Sulforaphane (20 μM) ngăn cản sự gia tăng activin A (p = 0,02) nhưng không ngăn chặn được 8-isoprostane.
Để tìm hiểu xem liệu tác động của sulforaphane đối với nguyên bào tế bào lông nhung có được trung gian qua con đường NRF2 hay không, nghiên cứu đã sử dụng RNA im lặng sợi đơn hướng vào NRF2 để ngăn chặn con đường này. Mặc dù NRF2 im lặng, sulforaphane tiếp tục làm giảm tiết sFlt-1 từ nguyên bào nuôi so với cả nuôi cấy không độc (p = 0,04) và thiếu oxy (p = 0,001). Tương tự, sự im lặng của NRF2 không ngăn chặn sự giảm thiểu sulforaphane của quá trình bài tiết activin A do X / XO gây ra (p = 0,01). Nghịch lý thay, các nhà nghiên cứu quan sát thấy sự gia tăng endoglin hòa tan (p = 0,007) khi sulforaphane được sử dụng cho các tế bào im lặng NRF2 trong điều kiện thiếu oxy (Hình 5). Ngoài ra, họ không thấy thay đổi đáng kể nào trong biểu hiện protein HO-1 ở bất kỳ nhóm điều trị nào (dữ liệu không được hiển thị).
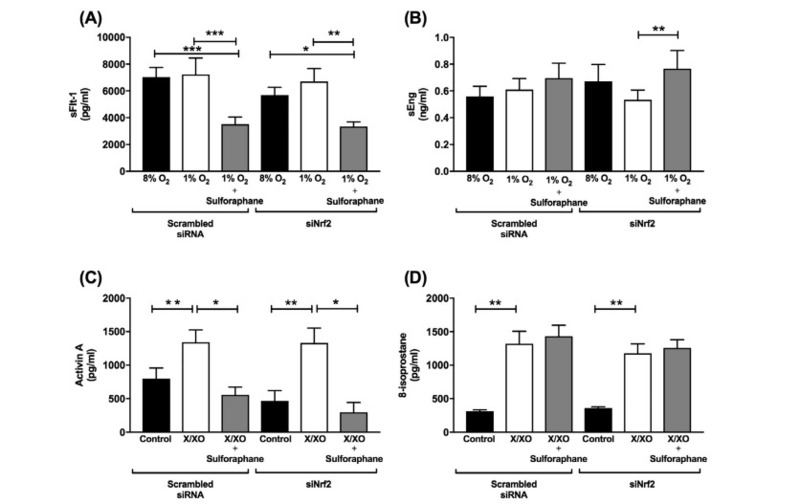
Hình 5. Ảnh hưởng của sulforaphane đối với các nguyên bào nuôi cấy lông nhung nhau thai được điều trị. Nguyên bào chí tuyến được ủ trong 24 giờ trong oxy 8% ở 37 ° c trước khi làm im lặng với trình tự im lặng mRNA sợi đơn hướng vào Nrf2 hoặc trình tự âm tính có xáo trộn. Sau 48 giờ, các mẫu được xử lý bằng X / XO và đưa trở lại 8% oxy ở 37 ° c, hoặc chuyển sang môi trường thiếu oxy 1% oxy ở 37 ° c, trong điều kiện không có sulforaphane (20 μM). Ở 72 giờ nồng độ (A) sFlt-1 và (B) sEng được định lượng trong dịch nổi thiếu oxy và (C) activin A và (D) 8-isoprostan được đo trong môi trường nuôi cấy được xử lý X / XO. Dữ liệu được biểu thị bằng giá trị trung bình ± SEM. * P <0,05, ** P <0,01, **** P <0,0001. n = 6 lá nhau.
3. Kết luận
Ở đây Sulforaphane đã được chứng minh rằng có thể bảo vệ các tế bào nội mô và làm giảm stress oxy hóa nhau thai. Cụ thể, trong tế bào nội mô, sulforaphane làm giảm tính thấm đơn lớp nội mô TNF-α và tiết ET-1, ICAM, VCAM và E-selectin. Trong mẫu nhau thai, sulforaphane làm giảm sự bài tiết của các yếu tố được biết là được điều chỉnh bởi tiền sản giật, bao gồm sFlt-1, sEng và activin A. Trong khi sự im lặng của NRF2 ngăn chặn tác dụng của sulforaphane trong HUVECs, nó không ngăn chặn sự giảm tiết sulforaphane do nguyên bào nuôi gây ra. sFlt-1 hoặc activin A, cho thấy rằng một số hoạt động của sulforaphane hoạt động thông qua các con đường khác ngoài NRF2.
Tổng kết lại, nghiên cứu đã chỉ ra rằng sulforaphane vừa có tác dụng bảo vệ nội mô, phần lớn mặc dù không chỉ thông qua các hoạt động chống oxy hóa qua trung gian NRF2, vừa có tác dụng bảo vệ trong việc giảm sản xuất nhau thai của các hợp chất kháng sinh. Tuy nhiên, việc sulforaphane thiếu khả năng giảm thiểu tất cả các tổn thương, trong tế bào nội mô hoặc nguyên bào nuôi, có khả năng phản ánh nhiều con đường gây ra những tổn thương như vậy, chỉ một số trong số đó là mục tiêu của sulforaphane. Tương tự, một số hoạt động của sulforaphane không bị chặn bởi sự im lặng của NRF2 cho thấy các cơ chế hoạt động khác, chưa được biết rõ. Rõ ràng là sự phát triển của các tác nhân phòng ngừa và điều trị mới trong tiền sản giật vẫn phụ thuộc vào việc làm sáng tỏ thêm về cơ chế bệnh sinh cơ bản của căn bệnh này. Điều đó nói rằng, các nhà nghiên cứu đề nghị rằng dữ liệu được báo cáo ở đây hỗ trợ nghiên cứu thêm về sulforaphane như một liệu pháp bổ trợ tiềm năng cho tiền sản giật.
4. Các chủ đề liên quan
Dưới đây là một số bài viết về các chủ đề nghiên cứu có liên quan đến hoạt chất Sulforaphane và công dụng của chúng:
- Sulforaphane làm giảm bớt độc tính do kim loại cadmium gây ra
- Tác dụng bảo vệ của chiết xuất bông cải xanh và Sulforaphane chống lại sự căng thẳng oxy hóa
- Sulforaphane : Một sản phẩm tự nhiên chống lại các loại oxy phản ứng
5. Tham vấn chuyên môn
- Bác sĩ
- Nguồn tham khảo: https://www.sciencedirect.com/science/article/abs/pii/S2210778918306664

