- Tổng quan
- 1. Nguyên liệu và phương pháp
- 1.1. Nuôi cấy tế bào
- 1.2. Động vật và giao thức thử nghiệm
- 1.3. Thử nghiệm hoạt động ADH
- 1.4. Thử nghiệm hoạt động ALDH2 của ty thể
- 2.5. Xét nghiệm tăng sinh tế bào
- 1.6. Phân tích mô học và hóa mô miễn dịch
- 1.7. Đo lường các chất phản ứng với axit thiobarbituric trong gan
- 1.8. Định lượng triglycerid trong gan
- 1.9. Xét nghiệm acetaldehyde trong gan
- 1.10. Tách chiết RNA và phản ứng chuỗi polymerase định lượng phiên mã ngược
- 1.11. Khai thác protein và phương pháp Western blot
- 1.12. Phân tích thống kê
- 2. Kết quả
- 2.1. Sulforaphane khuếch đại hoạt động ALDH2 trong tế bào HepaRG và ngăn chặn sự tăng sinh và hoạt hóa do acetaldehyde gây ra trong tế bào LX-2
- 2.2. Sulforaphane có tác dụng chống oxy hóa với cảm ứng ALDH2 trong xơ hóa gan do tiếp xúc với ethanol ở chuột được điều trị bằng CCl4
- 2.3. Sulforaphane bảo vệ khỏi sự xâm nhập của tế bào Kupffer và sự kích hoạt qua trung gian LPS của con đường truyền tín hiệu thụ thể số 4 trong gan của những con chuột được điều trị bằng CCl4 tiếp xúc với ethanol
- 2.4. Sulforaphane ức chế sự xơ hóa gan ở những con chuột được điều trị bằng CCl4 tiếp xúc với ethanol
- 2.5. Sulforaphane ức chế hoạt động tạo tiền bào qua trung gian LPS và sản xuất ROS trong tế bào LX-2
- 3. Kết luận
- 4. Các chủ đề liên quan
- 5. Tham vấn chuyên môn
Xơ gan có thể được cải thiện bằng hợp chất Sulforaphane không? Nghiên cứu chứng minh có kết quả như thế nào đối với việc tác động của nó đến bệnh xơ gan?
Tổng quan
Xơ gan liên quan đến bệnh gan do rượu (ALD) là kết quả của nhiều cơ chế bao gồm sự tích tụ acetaldehyde, các loại oxy phản ứng và tình trạng quá tải ở gan của lipopolysaccharide nội sinh (LPS). Cai rượu là phương pháp điều trị chính cho bệnh nhân mắc tất cả các giai đoạn của ALD, trong khi các chiến lược dược lý để điều trị xơ hóa gan vẫn chưa được thiết lập. Sulforaphane, một chất hóa thực vật được tìm thấy trong các loại rau họ cải có thể kích hoạt yếu tố hạt nhân erythroid 2 liên quan đến yếu tố 2 (Nrf2) và có tác dụng chống ung thư, trị tiểu đường và kháng khuẩn. Tuy nhiên, chỉ có một vài nghiên cứu điều tra hiệu quả của nó trong sự phát triển của bệnh xơ hóa liên quan đến ALD.
Nghiên cứu này sẽ đánh giá tác động của Sulforaphane đối với chuyển hóa acetaldehyde và xơ hóa gan ở tế bào HepaRG và LX-2, khối u gan người và dòng tế bào hình sao gan, cũng như trên mô hình chuột bị xơ hóa gan do rượu gây ra bởi ethanol và carbon tetrachloride (EtOH / CCl4). Điều trị bằng Sulforaphane kích thích sự hoạt động của aldehyde dehydrogenase ty thể chuyển hóa acetaldehyde trong tế bào HepaRG và ức chế sự tăng sinh do acetaldehyde gây ra và hoạt động sinh nguyên bào trong tế bào LX-2 với sự điều chỉnh của các gen chống oxy hóa điều chỉnh Nrf2, bao gồm HMOX1, NQO1 và GSTM3.
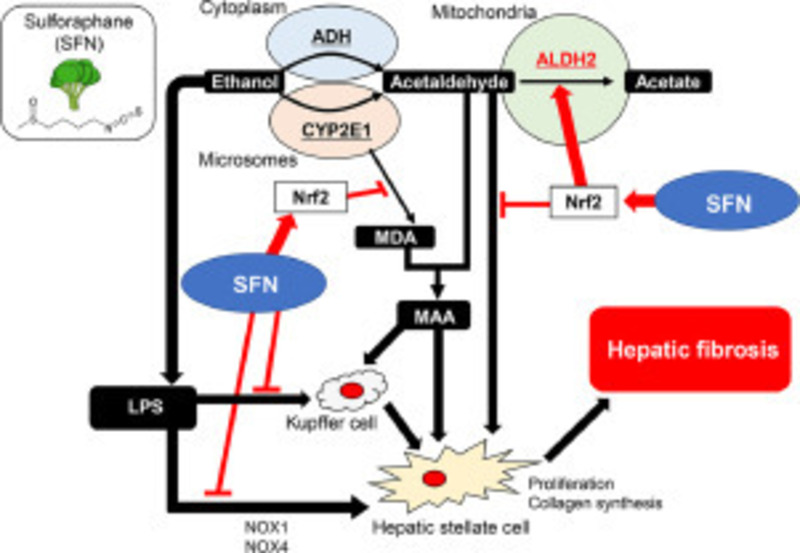
Hơn nữa, Sulforaphane cũng làm giảm độ nhạy cảm qua trung gian LPS / thụ thể giống số 4 để chuyển đổi yếu tố tăng trưởng-β với sự điều hòa giảm NADPH oxidase 1 (NOX1) và NOX4. Ở những con chuột được điều trị bằng EtOH / CCl4, sử dụng Sulforaphane đường uống có thể làm tăng chuyển hóa acetaldehyde ở gan. Ngoài ra, Sulforaphane cũng ức chế đáng kể sự xâm nhập và xơ hóa tế bào Kupffer, giảm tích tụ chất béo và peroxy hóa lipid, đồng thời gây ra các gen đáp ứng chống oxy hóa điều chỉnh Nrf2 ở chuột được điều trị bằng EtOH / CCl4. Hơn nữa, điều trị bằng Sulforaphane sẽ làm giảm tiếp xúc với gan của LPS có nguồn gốc từ ruột và ức chế con đường truyền tín hiệu giống thụ thể 4 ở gan. Tổng hợp lại, những kết quả này cho thấy Sulforaphane là một chiến lược điều trị khả quan mới trong bệnh xơ hóa gan liên quan đến ALD.
1. Nguyên liệu và phương pháp

1.1. Nuôi cấy tế bào
LX-2, dòng HSC dành cho người và HSC-T6, dòng HSC của chuột, được mua từ Merck (Darmstadt, Đức). Dòng ung thư gan người HepG2 được lấy từ Ngân hàng Tế bào Riken BRC (Ibaraki, Nhật Bản). Tế bào HepaRG được mua từ Công ty KAC (Kyoto, Nhật Bản). Tế bào HepaRG và các dòng tế bào khác được nuôi cấy tương ứng trong môi trường RPMI-1640 và môi trường Eagle cải tiến của Dulbecco, được bổ sung 10% huyết thanh bò thai (Gibco, Thermo Fisher Scientific, Waltham, MA, USA) và 1% penicilin / streptomycin trong tủ ấm ở 37°C và 5% CO2. Đối với tất cả các thử nghiệm, các tế bào được ủ với Sulforaphane, acetaldehyde, LPS (O55:B5) và/hoặc TGF-β1 của người tái tổ hợp. Sulforaphane và acetaldehyde lần lượt được mua từ Toronto Research Chemicals (Toronto, ON, Canada) và Wako Pure Chemical Industries (Osaka, Nhật Bản). LPS (O55: B5) và TGF-β1 tái tổ hợp của người được thu nhận từ Sigma-Aldrich (St. Louis, MO, Hoa Kỳ).
1.2. Động vật và giao thức thử nghiệm
Chuột cái C57BL / 6J cái 10 tuần tuổi (CLEA Japan, Osaka, Japan) được chia thành bốn nhóm ăn kiêng (n = 10 con chuột / nhóm).
- Những con chuột trong nhóm chế độ ăn đối chứng (CD) được cho ăn theo chế độ ăn lỏng bình thường (Research Diets, New Brunswick, NJ, USA).
- Những con chuột trong nhóm CD / CCl4 được cho ăn chế độ ăn lỏng bình thường và nhận CCl4 1 mL / kg thể trọng hòa tan trong dầu ngô (Nacalai Tesque, Kyoto, Nhật Bản) bằng cách tiêm vào phúc mạc hai lần mỗi tuần.
- Những con chuột trong nhóm ED / CCl4 được cho ăn chế độ ăn lỏng Lieber-DeCarli 2,5% (v / v) (Chế độ ăn kiêng nghiên cứu) (ED) và được tiêm CCl4 trong phúc mạc hai lần mỗi tuần (1 mL / kg thể trọng).
- Những con chuột trong nhóm ED / CCl4 / SFN được cho ăn kết hợp ED với Sulforaphane và được tiêm CCl4 trong phúc mạc (1 mL / kg thể trọng) hai lần mỗi tuần; trong nhóm này, Sulforaphane được sử dụng đường tiêm dưới dạng hỗn hợp ED (5 μmoL / ngày / trọng lượng cơ thể).
Cùng một lượng hyđrat lactose đã được sử dụng làm phương tiện cho các nhóm CD, CD / CCl4 và ED / CCl4. Tất cả các con chuột được nhốt trong lồng lưới thép không gỉ trong điều kiện được kiểm soát (23 ° C ± 3 ° C với độ ẩm tương đối là 50% ± 20%, 10–15 lần thay đổi không khí / giờ và 12 giờ ánh sáng / ngày). Chúng được cho phép tiếp cận với nước máy trong suốt thời gian thí nghiệm. Tất cả các con chuột đều chết sau 8 tuần cho ăn.
Kết thúc thí nghiệm, tất cả các con chuột đều trải qua các quy trình sau: gây mê, mở khoang bụng, lấy máu qua chọc dò động mạch chủ và lấy gan để đánh giá mô học. Các chất chỉ điểm sinh học huyết thanh được đánh giá bằng các phương pháp phòng thí nghiệm thông thường. Nồng độ etanol trong máu được đo bằng Bộ xét nghiệm Ethanol (BioVision, Milpitas, CA, US) theo hướng dẫn của nhà sản xuất. Tất cả các quy trình động vật được thực hiện tuân theo các khuyến nghị của Hướng dẫn Chăm sóc và Sử dụng Động vật Phòng thí nghiệm của Hội đồng Nghiên cứu Quốc gia, và nghiên cứu đã được Ủy ban Chăm sóc Động vật của Đại học Y Nara phê duyệt (số ủy quyền: 12336).
1.3. Thử nghiệm hoạt động ADH
Hoạt động ADH trong tế bào HepaRG được đo bằng Bộ xét nghiệm Alcohol Dehydrogenase (Abcam, Cambridge, Vương quốc Anh) theo hướng dẫn của nhà sản xuất.
1.4. Thử nghiệm hoạt động ALDH2 của ty thể
Hoạt động ALDH2 trong tế bào HepaRG và các mẫu mô gan được xác định bằng bộ xét nghiệm hoạt động ALDH2 (Abcam) theo quy trình của nhà sản xuất. ALDH2 được xác định bằng cách đo NADH được tạo ra do phản ứng có xúc tác ALDH2 sau:
Acetaldehyde + NAD + → axit axetic + NADH
Một cách ngắn gọn, tế bào HepaRG ở nồng độ 1,5 × 104 tế bào / mL được cấy trên đĩa nuôi cấy mô nhựa không tráng phủ và được xử lý bằng Sulforaphane ở các nồng độ khác nhau (0–40 μM) trong một thời gian (12–48 giờ). Các tế bào, cũng như các chất đồng nhất từ các mô gan đều được hòa tan và dung dịch hoạt tính bao gồm thuốc nhuộm phóng xạ được thêm vào các chất nổi. Hoạt tính ALDH2 được xác định bằng cách đo độ hấp thụ mẫu ở bước sóng 450 nm sử dụng Multiskan FC (Thermo Fisher Scientific, Waltham, MA, USA).
2.5. Xét nghiệm tăng sinh tế bào
Tế bào LX-2 hoặc HSC-T6 được cấy trên đĩa nuôi cấy mô nhựa không tráng phủ ở mật độ 1,5 × 104 tế bào / mL và được xử lý với các nồng độ khác nhau của acetaldehyde (0–200 μM) và Sulforaphane (0–40 μM) trong 24 giờ. Hệ thống xét nghiệm tăng sinh tế bào Premix WST-1 (Takara Bio, Kusatsu, Nhật Bản) được sử dụng để đánh giá sự tăng sinh tế bào.
1.6. Phân tích mô học và hóa mô miễn dịch
Các mẫu gan được cố định trong 10% formalin và nhúng vào parafin. Để đánh giá mô học, các phần dày 5 μm được nhuộm bằng hematoxylin / eosin và Sirius Red. Để nhuộm miễn dịch, các kháng thể chính chống lại α-actin cơ trơn (α-SMA) (ab5494, 1: 200; Abcam) và F4 / 80 (ab100790, 1: 100; Abcam) đã được sử dụng, theo khuyến nghị của nhà sản xuất. Tất cả các phân tích định lượng bao gồm năm trường trên mỗi phần ở độ phóng đại 400 × và được thực hiện bởi phần mềm NIH ImageJ.
1.7. Đo lường các chất phản ứng với axit thiobarbituric trong gan
Sau khi đồng nhất các mô gan đông lạnh (25 mg), các chất phản ứng với axit thiobarbituric trong gan (TBARS) được đánh giá bằng cách đo hàm lượng malondialdehyde trong gan bằng cách sử dụng bộ xét nghiệm TBARS (Cayman Chemical, Ann Arbor, MI, USA), theo hướng dẫn của nhà sản xuất.
1.8. Định lượng triglycerid trong gan
Nồng độ chất béo trung tính trong gan được đo trong 100 mg mô gan đông lạnh trên mỗi con vật bằng cách sử dụng Bộ xét nghiệm định lượng chất béo trung tính (Abcam), theo hướng dẫn của nhà sản xuất.
1.9. Xét nghiệm acetaldehyde trong gan
Sau khi đồng nhất hóa các mô gan đông lạnh (40 mg), nồng độ acetaldehyde trong gan được đo bằng bộ thử nghiệm Acetaldehyde (EACT100; BioAssay System, Hayward, CA, USA), theo hướng dẫn của nhà sản xuất.
1.10. Tách chiết RNA và phản ứng chuỗi polymerase định lượng phiên mã ngược
RNA tổng số được phân lập từ các mô gan và tế bào nuôi cấy bằng cách sử dụng RNeasy Mini Kit (Qiagen, Hilden, Đức) và được phiên mã ngược thành DNA bổ sung (cDNA) bằng cách sử dụng bộ kit RNA-to-cDNA dung lượng cao (Hệ thống sinh học ứng dụng, Thành phố Foster, CA, USA), theo hướng dẫn của nhà sản xuất. Phản ứng chuỗi polymerase định lượng phiên mã ngược của cDNA với các cặp mồi dành riêng cho gen (Bảng bổ sung. 1) được thực hiện bằng cách sử dụng hệ thống PCR thời gian thực StepOnePlus và SYBR Green từ Hệ thống sinh học ứng dụng (Applied Biosystems). Mức độ biểu hiện gen tương đối được xác định bằng cách sử dụng glyceraldehyde-3-phosphate dehydrogenase (GAPDH) làm kiểm soát nội bộ. Lượng mRNA mục tiêu tương đối trên mỗi chu kỳ được xác định bằng cách áp dụng chu kỳ ngưỡng cho đường cong chuẩn. Tất cả các phản ứng được thực hiện bằng cách sử dụng cDNA pha loãng 1:10 và mức độ biểu hiện mRNA được ước tính bằng cách sử dụng phương pháp 2− CT và được trình bày dưới dạng các thay đổi gấp so với đối chứng.
1.11. Khai thác protein và phương pháp Western blot
Dịch ly giải toàn bộ tế bào được chuẩn bị từ các tế bào được nuôi cấy. Tế bào LX-2 (1 × 106) được ủ trước bằng Sulforaphane (5 hoặc 20 μM) và LPS (O55: B5, 100 ng / mL) trong 12 giờ. Thuốc thử chiết xuất protein mô T-PER có bổ sung các chất ức chế proteinase và phosphatase (Thermo Fisher Scientific) được sử dụng để điều chế các chất phân giải. Nồng độ protein được đo bằng xét nghiệm protein Bradford (Bio-Rad, Hercules, CA, USA) và tất cả các mẫu đều được chuẩn hóa thành 50 μg / mL.
Các protein tế bào được phân tách bằng điện di trên gel natri dodecyl sulfat-polyacrylamide 4–12% và được chuyển sang màng Invitrolon polyvinylidene difluoride (Thermo Fisher Scientific). Tiếp theo, các màng được chặn bằng albumin huyết thanh bò 5% trong nước muối đệm Tris được bổ sung với Tween-20 trong 1 giờ. Các kháng thể chính sau đây từ Công nghệ Tín hiệu Tế bào (Danvers, MA, Hoa Kỳ) đã được sử dụng cho miễn dịch hấp thụ: ADH1 (# 5295; 1: 1000), ALDH2 (# 18818; 1: 1000), yếu tố hạt nhân kappa B (NF-κB) p65 (# 8242; 1: 1000), photpho-NF-κB p65 (Ser536; # 3033; 1: 1000) và β-actin (# 4967; 1:10 000). Amersham ECL ECL peroxidase liên kết đoạn IgG F (ab) 2 (1: 5000; GE Healthcare Life Sciences, Piscataway, NJ, USA) được sử dụng làm kháng thể thứ cấp. Các dải được hình dung bằng cách sử dụng chất nền Clarity Western ECL (Bio-Rad).
1.12. Phân tích thống kê
Dữ liệu được phân tích bằng phép thử T Student hoặc phân tích phương sai một chiều, sau đó là bài kiểm tra so sánh nhiều lần của Bonferroni, nếu thích hợp. Kiểm định của Bartlett được sử dụng để xác định tính đồng nhất của các phương sai. Tất cả các thử nghiệm đều có hai phía và giá trị P <0,05 được coi là biểu thị ý nghĩa thống kê
2. Kết quả
2.1. Sulforaphane khuếch đại hoạt động ALDH2 trong tế bào HepaRG và ngăn chặn sự tăng sinh và hoạt hóa do acetaldehyde gây ra trong tế bào LX-2
Đầu tiên chúng tôi xác định liệu Sulforaphane có thể ảnh hưởng đến hoạt động của ADH và ALDH2 trong quá trình chuyển hóa ethanol và acetaldehyde trong tế bào gan hay không. Như trong hình 1A, tế bào HepaRG biểu hiện cả ADH1 và ALDH2 trong khi tế bào HepG2 chỉ biểu hiện ALDH2. Do đó, chúng tôi sử dụng tế bào HepaRG để đánh giá tác động của Sulforaphane đối với chuyển hóa ethanol và acetaldehyde. Phù hợp với vai trò được xác định của nó là chất hoạt hóa Nrf2, Sulforaphane làm tăng mức mRNA của các gen chống oxy hóa được điều chỉnh bởi Nrf2 bao gồm HMOX1, NQO1 và glutathione S-transferase 3 (GSTM3) theo cách phụ thuộc vào liều lượng (5, 10, 20 và 40 μM) trong tế bào HepaRG (Hình 1B).
Hoạt động ADH trong tế bào HepaRG không bị thay đổi khi điều trị bằng Sulforaphane ở các nồng độ khác nhau (Hình 1C). Trong khi đó, điều trị với nồng độ Sulforaphane được chỉ định trong 48 giờ dẫn đến sự gia tăng đáng kể hoạt động ALDH2 trong tế bào HepaRG. Phân tích theo thời gian cho thấy hoạt động ALDH2 18 giờ sau khi điều trị cao hơn đáng kể so với hoạt động đo được khi bắt đầu điều trị ở các tế bào được điều trị bằng 20 μM Sulforaphane (Hình 1D).
Chúng tôi đã xác nhận những tác động này của Sulforaphane đối với hoạt động của ALDH2 trong tế bào HepG2 (Hình bổ sung. 1A và 1B). Tiếp theo, chúng tôi đánh giá ảnh hưởng trực tiếp của Sulforaphane đối với hoạt động tăng sinh và tạo sợi của acetaldehyde trong HSC. Như được thể hiện trong Hình 1E, acetaldehyde thúc đẩy đáng kể sự tăng sinh của tế bào LX-2, một dòng HSC của người trong khi điều trị bằng Sulforaphane ức chế hiệu quả sự tăng sinh do acetaldehyde gây ra theo cách phụ thuộc vào liều lượng (Hình 1F).
Hơn nữa, 200 μM acetaldehyde làm tăng đáng kể mức độ biểu hiện mRNA của một số dấu hiệu xơ hóa, bao gồm actin alpha 2 (ACTA2), TGFB1 và COL1A1, trong khi Sulforaphane làm giảm đáng kể sự gia tăng mức độ biểu hiện quan sát được của các gen này (Hình 1G). Ngoài ra, chúng tôi xác nhận rằng Sulforaphane có tác dụng chống tăng sinh và chống tạo sợi trong tế bào HSC-T6, một dòng HSC của chuột (Hình bổ sung. 1C-1E).
Chúng tôi cũng đánh giá phản ứng chống oxy hóa qua trung gian Nrf2 ở các HSC được điều trị bằng Sulforaphane. Ở các tế bào LX-2, việc điều trị bằng acetaldehyde không làm thay đổi mức mRNA của các gen chống oxy hóa điều hòa Nrf2, mức độ biểu hiện của chúng tăng lên đáng kể khi sử dụng Sulforaphane (Hình 1H). Những phát hiện này gợi ý rằng Sulforaphane thể hiện tác dụng chống oxy hóa trực tiếp thông qua việc kích hoạt các con đường tín hiệu Nrf2 trong Ac-HSCs và cảm ứng hoạt động ALDH2 trong tế bào gan.
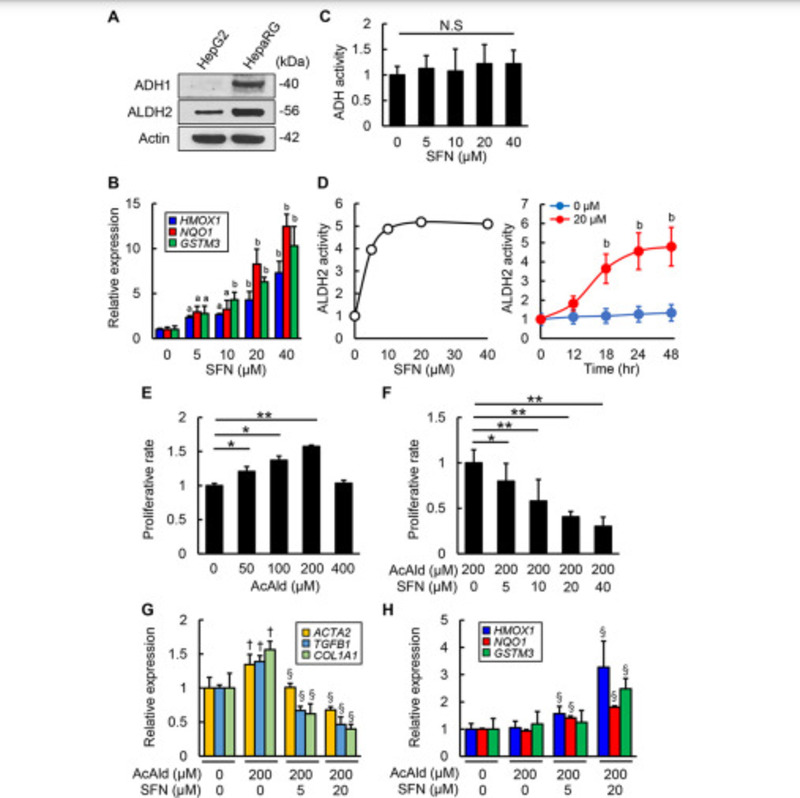
Hình 1. Ảnh hưởng của sulforaphane đến chuyển hóa acetaldehyde trong ống nghiệm và kích thích hoạt hóa HSC do acetaldehyde. (A) Western blots đối với biểu hiện protein alcohol dehydrogenase (ADH) 1 và aldehyde dehydrogenase ty thể (ALDH2) trong tế bào HepG2 và HepaRG. Actin được sử dụng như một bộ điều khiển tải. (B) Mức độ biểu hiện mRNA tương đối của HMOX1, NQO1 và GSTM3 trong tế bào HepaRG. (C) Ảnh hưởng của SFN đến hoạt động của ADH trong tế bào HepaRG. (D) Tác động phụ thuộc vào liều lượng và thời gian của SFN đối với hoạt động của ALDH2 trong tế bào HepaRG. Các tế bào được nuôi cấy trong 24 giờ trong thử nghiệm phụ thuộc vào liều lượng và ở 0 hoặc 20 μM SFN trong thử nghiệm phụ thuộc vào thời gian. (E) Sự tăng sinh tế bào của tế bào LX-2 được kích thích bởi acetaldehyde (AcAld) (0, 50, 100, 200 và 400 μM). (F) Sự tăng sinh tế bào của tế bào LX-2 trùng hợp với 200 μM AcAld và được xử lý bằng SFN (0, 5, 10, 20 và 40 μM). (G và H) Ảnh hưởng của SFN lên các biểu hiện mRNA của (G) ACTA2, TGFB1, COL1A1 và (H) HMOX1, NQO1, GSTM3 trong các tế bào LX-2 được AcAld kích thích. Các tế bào được nuôi cấy với AcAld (200 μM) và SFN (0, 5, và 20 μM) trong 24 giờ. Tế bào HepaRG được nuôi cấy bằng sulforaphane (SFN) (0, 5, 10, 20 và 40 μM) trong 24 giờ (A-C). Các giá trị định lượng được chỉ định một cách tương đối khi các thay đổi gấp đối với các giá trị của các nhóm không điều trị. Mức độ biểu hiện mRNA được đo bằng qRT-PCR và GAPDH được sử dụng làm kiểm soát nội bộ cho qRT-PCR. Dữ liệu là trung bình ± SD (n = 8) (A-H). aP <.05; bP <0,01, cho thấy sự khác biệt đáng kể so với đối chứng âm tính (sulforaphane 0 μM) (B và D). ∗ P <.05; ∗∗ P <0,01, cho thấy sự khác biệt đáng kể giữa các nhóm (C, E và F). † P <.05; §P <0,05, cho thấy sự khác biệt đáng kể so với AcAld (0 μM) / SFN (0 μM) và AcAld (200 μM) / SFN (0 μM), tương ứng (G và H).
2.2. Sulforaphane có tác dụng chống oxy hóa với cảm ứng ALDH2 trong xơ hóa gan do tiếp xúc với ethanol ở chuột được điều trị bằng CCl4
Dựa trên những tác dụng có lợi quan sát được của Sulforaphane trong tế bào gan và HSC trong ống nghiệm, tiếp theo, chúng tôi đánh giá tác dụng của Sulforaphane đối với tổn thương gan mãn tính trên cơ thể bằng cách sử dụng ethanol trong kết hợp với CCl4 để gây xơ hóa gan ở chuột. Quy trình thử nghiệm được trình bày trong Hình 2A. Vào cuối thí nghiệm, những con chuột được sử dụng CCl4 lặp lại và tiếp xúc với ethanol mãn tính không giảm cân đáng kể so với nhóm đối chứng (Hình 2B). Trong khi chỉ sử dụng CCl4 không dẫn đến thay đổi trọng lượng gan, tiêu thụ ethanol làm tăng đáng kể trọng lượng gan ở những con chuột được điều trị CCl4, vốn bị ức chế bằng cách điều trị bằng sulforaphane (Hình 2C).
Nồng độ aspartate aminotransferase và alanin aminotransferase trong huyết thanh đã tăng lên khi sử dụng CCl4, và phơi nhiễm ethanol mãn tính làm tăng những thay đổi này ở những con chuột được điều trị bằng CCl4 (Hình 2D). Điều thú vị là điều trị bằng Sulforaphane đã làm giảm đáng kể nồng độ aspartate aminotransferase và alanine aminotransferase ở những con chuột được điều trị bằng CCl4 tiếp xúc với ethanol (Hình 2D).
Nồng độ albumin huyết thanh không thay đổi khi điều trị bằng Sulforaphane, cho thấy rằng Sulforaphane không ảnh hưởng đến tái tạo tế bào gan (Hình 2E). Ngoài ra, Sulforaphane cải thiện tình trạng tăng triglycerid máu nhưng không làm thay đổi nồng độ cholesterol trong huyết thanh ở những con chuột được điều trị bằng CCl4 tiếp xúc với ethanol (Hình 2F và 2G).
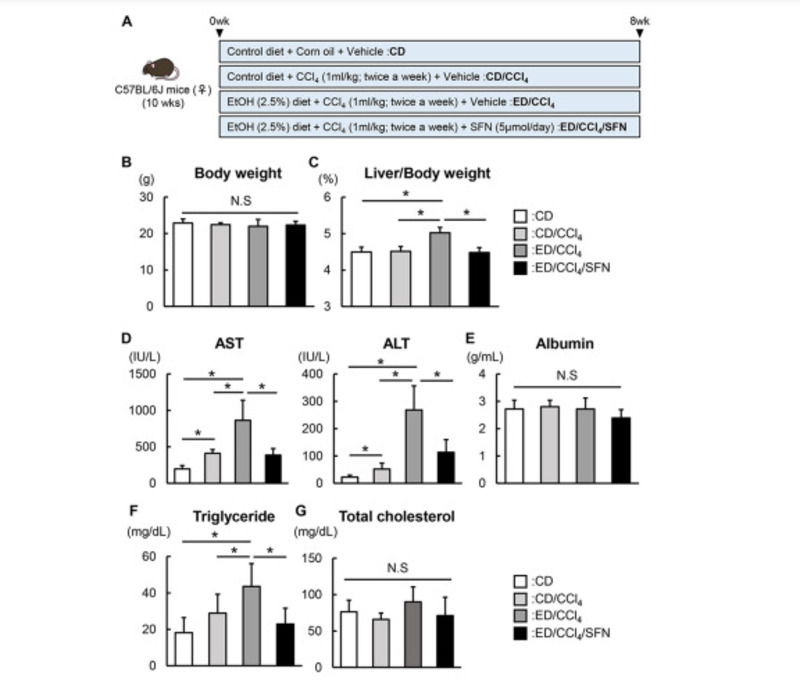
Hình 2. Các tính năng đặc trưng của mô hình chuột gây ra bởi ethanol cộng với CCl4. (A) Các giao thức thử nghiệm. (B) Khối lượng cơ thể ở các nhóm thí nghiệm khi kết thúc thí nghiệm. (C) Tỉ lệ giữa khối lượng gan và khối lượng cơ thể ở các nhóm thí nghiệm khi kết thúc thí nghiệm. (D-G) Mức độ huyết thanh của aspartate transaminase (AST), alanin aminotransferase (ALT), albumin, triglycerid và cholesterol toàn phần trong các nhóm thí nghiệm. Dữ liệu có giá trị trung bình ± SD (n = 10). ∗ P <0,05, cho thấy sự khác biệt đáng kể giữa các nhóm. N.S; không đáng kể.
Tiếp theo, chúng tôi điều tra sự biểu hiện và hoạt động của ALDH2 ở gan trong mô hình động vật của chúng tôi. Chúng tôi không tìm thấy sự khác biệt về nồng độ ethanol trong máu giữa nhóm ED / CCl4 và nhóm ED / CCl4 / SFN, cho thấy Sulforaphane không ảnh hưởng đến sự hấp thụ ethanol qua đường tiêu hóa (Hình 3A). Trong khi đó, nồng độ acetaldehyde trong gan ở những con chuột được điều trị bằng Sulforaphane thấp hơn đáng kể so với những con được điều trị bằng phương tiện ở những con chuột được điều trị bằng CCl4 tiếp xúc với ethanol cho thấy rằng Sulforaphane có thể thúc đẩy quá trình chuyển hóa acetaldehyde ở gan một cách hiệu quả (Hình 3B).
Đáng ngạc nhiên là việc sử dụng CCl4 đã điều chỉnh đáng kể nồng độ mRNA ở gan của Aldh2 bất kể tiếp xúc với ethanol (Hình 3C) trong khi điều trị bằng Sulforaphane ức chế sự giảm biểu hiện Aldh2 ở gan qua trung gian CCl4 (Hình 3C). Phù hợp với sự thay đổi quan sát được trong biểu hiện Aldh2, Sulforaphane đã ngăn chặn sự mất hoạt động ALDH2 của gan ở những con chuột được điều trị bằng CCl4 (Hình 3D). Đánh giá mô học với nhuộm hematoxylin / eosin xác nhận sự hiện diện của nhiễm mỡ gan ở những con chuột được điều trị bằng CCl4 tiếp xúc với ethanol và cho thấy rằng điều trị bằng Sulforaphane đã cải thiện tình trạng nhiễm mỡ ở gan, được xác nhận là do giảm mức triglycerid ở gan (Hình 3E và 3F). Phù hợp với tình trạng nhiễm mỡ gan được quan sát thấy, điều trị bằng Sulforaphane làm giảm đáng kể hàm lượng malondialdehyde trong gan, một sản phẩm peroxy hóa lipid của các axit béo không bão hòa đa, ở những con chuột được điều trị CCl4 tiếp xúc với ethanol (Hình 3G).
Hơn nữa, chúng tôi phát hiện ra rằng Sulforaphane điều chỉnh mức độ biểu hiện mRNA ở gan của các gen chống oxy hóa bao gồm Hmox1, Nqo1 và Gstm3 ở những con chuột được điều trị CCl4 tiếp xúc với ethanol, phản ánh sự gia tăng kích hoạt Nrf2 (Hình 3H). Những con chuột được điều trị CCl4 tiếp xúc với ethanol cho thấy mức mRNA của các thành viên họ gen NADPH oxidase (NOX) ở gan, Nox1, Nox2 và Nox4 cao hơn đáng kể so với những con chuột đối chứng và những con chuột được điều trị chỉ với CCl4; điều trị bằng SFN làm giảm đáng kể sự gia tăng mức mRNA NADPH oxidase quan sát được (Hình 3I). Những phát hiện này cho thấy rằng Sulforaphane có thể bảo vệ khỏi stress oxy hóa thông qua hoạt hóa Nrf2 độc lập với tác dụng của nó đối với sự tích tụ chất béo.
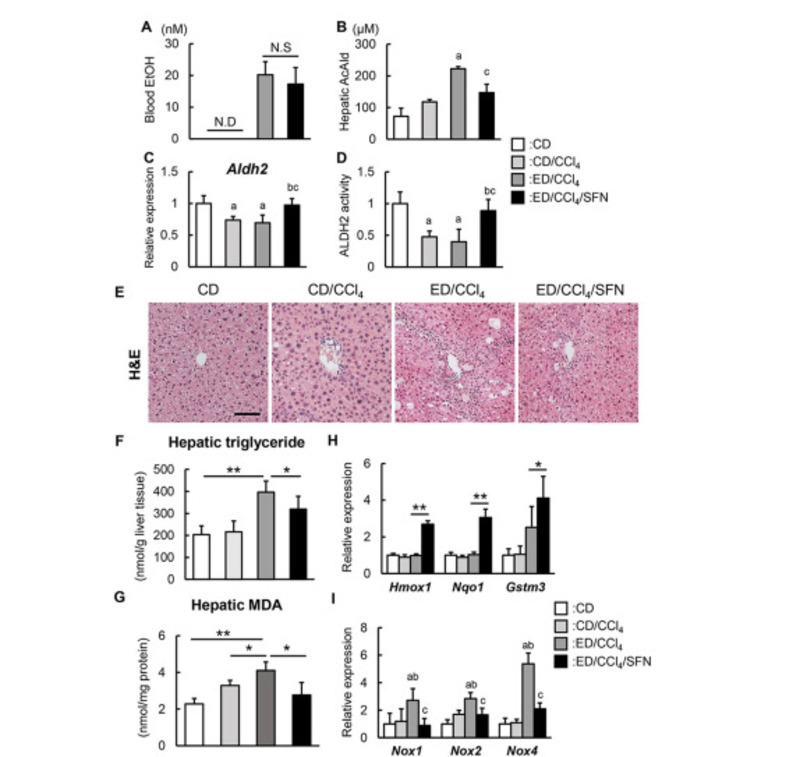
Hình 3. Ảnh hưởng của sulforaphane đối với chuyển hóa acetaldehyde ở gan in vivo, tích tụ chất béo và stress oxy hóa. (A) Nồng độ etanol trong máu khi kết thúc thí nghiệm. (B) Nồng độ acetaldehyde trong gan của chuột thí nghiệm. (C) Mức độ biểu hiện mRNA tương đối của Aldh2 trong gan của chuột thí nghiệm. (D) Hoạt động ALDH2 trong gan của chuột thí nghiệm. Hoạt động được biểu thị dưới dạng thay đổi gấp đối với các giá trị của nhóm CD. (E) Ảnh vi mô đại diện nhuộm hematoxylin và eosin (H&E) trong các nhóm thí nghiệm. Thanh tỷ lệ; 50 μm. (F) Nồng độ triglycerid trong gan của các nhóm thí nghiệm. (G) Mức độ malondialdehyde (MDA) trong gan trong các nhóm thí nghiệm. (H và I) Mức độ biểu hiện mRNA tương đối của (H) Hmox1, Nqo1, Gstm3 và (I) Nox1, Nox2, Nox4 trong gan của chuột thí nghiệm. Định nghĩa nhóm thực nghiệm được trình bày trong Hình 2A. Mức độ biểu hiện mRNA được đo bằng qRT-PCR và Gapdh được sử dụng làm kiểm soát nội bộ cho qRT-PCR. Các giá trị định lượng được chỉ ra là các thay đổi gấp đối với các giá trị của nhóm CD (A, G và H). Dữ liệu là trung bình ± SD (n = 10) (A-C và E-H). aP <0,05, aaP <0,01 so với nhóm CD, bP <0,05, bbP <0,01 so với nhóm CD / CCl4, cP <0,05, ccP <0,01 so với nhóm ED / CCl4 (AC và EH) . N.S; không đáng kể.
2.3. Sulforaphane bảo vệ khỏi sự xâm nhập của tế bào Kupffer và sự kích hoạt qua trung gian LPS của con đường truyền tín hiệu thụ thể số 4 trong gan của những con chuột được điều trị bằng CCl4 tiếp xúc với ethanol
Dựa trên những cải thiện quan sát được về stress oxy hóa gây ra bởi ethanol và CCl4 sau khi điều trị bằng Sulforaphane, tiếp theo, chúng tôi đánh giá tình trạng viêm trong các mẫu gan của chuột trong các điều kiện thí nghiệm khác nhau. Như thể hiện trong Hình 4A, chúng tôi quan sát thấy sự xâm nhập qua gan của các tế bào Kupffer (KCs) F4 / 80 dương tính ở những con chuột được điều trị bằng CCl4, tỷ lệ này lan rộng hơn ở những con chuột được điều trị bằng CCl4 tiếp xúc với ethanol. Sự mở rộng thâm nhập KC này đã giảm đi đáng kể khi điều trị bằng Sulforaphane (Hình 4A). Phân tích bán định lượng có sự hỗ trợ của máy tính đối với các tế bào F4 / 80- dương tính cho thấy rằng số lượng KC đã giảm hơn 70% với Sulforaphane ở những con chuột được điều trị CCl4 tiếp xúc với ethanol so với điều trị bằng phương tiện ở những con chuột được điều trị CCl4 tiếp xúc với ethanol (Hình 4B). Song song với việc giảm sự xâm nhập của KCs, nồng độ mRNA ở gan của Cd68 đã giảm đáng kể khi điều trị bằng sulforaphane ở những con chuột được điều trị bằng CCl4 tiếp xúc với ethanol (Hình 4C).
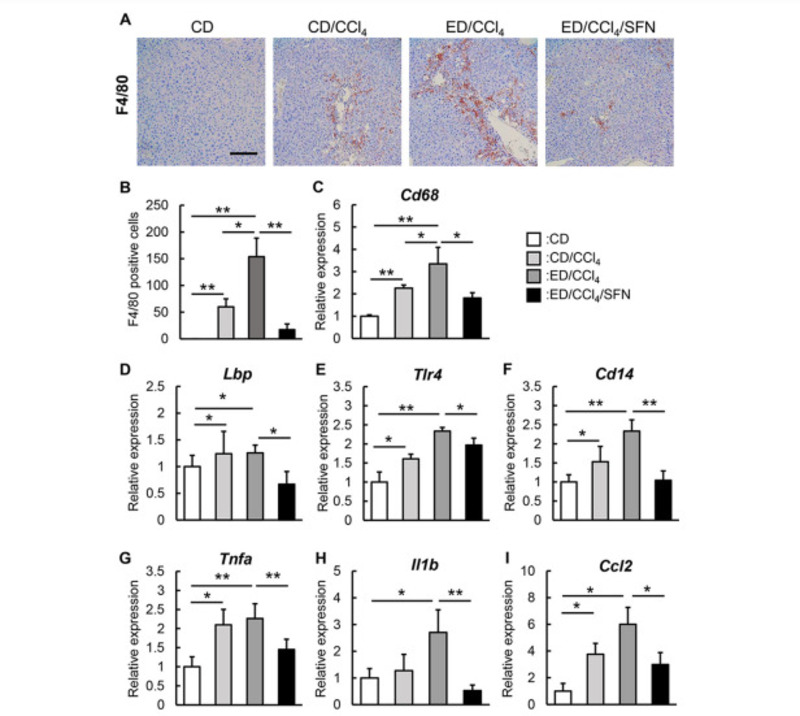
Hình 4. Ảnh hưởng của sulforaphane đối với sự xâm nhập của tế bào Kupffer và con đường truyền tín hiệu LPS / TLR4 trong chuột gây ra bởi ethanol cộng với CCl4. (A) Ảnh vi mô đại diện của các phần gan được nhuộm F4 / 80. Thanh chia độ: 50 μm. (B) Bán định lượng tế bào Kupffer dương tính với miễn dịch F4 / 80 trong trường năng lượng cao (HPF) bằng phần mềm NIH imageJ. (C-I) Mức độ biểu hiện mRNA tương đối của (C) Cd68, (D) Lbp, (E) Tlr4, (F) Cd14, (G) Tnfa, (H) Il1b, và (I) Ccl2 trong gan của chuột thí nghiệm. Mức độ biểu hiện mRNA được đo bằng qRT-PCR và Gapdh được sử dụng làm kiểm soát nội bộ cho qRT-PCR. Các giá trị định lượng được chỉ ra là các thay đổi gấp đối với các giá trị của nhóm CD (C-I). Dữ liệu là trung bình ± SD (n = 10), ∗ P <0,05, ∗∗ P <0,01, cho thấy sự khác biệt đáng kể giữa các nhóm (B-I).
Tiếp theo, chúng tôi xem xét tác động của Sulforaphane trên con đường truyền tín hiệu LPS ở gan / thụ thể giống thụ thể 4 (TLR4) ở gan. Những con chuột được điều trị bằng CCl4 tiếp xúc với ethanol cho thấy sự gia tăng mức mRNA ở gan của protein liên kết LPS (Lbp), liên kết với LPS để tạo thành một phức hợp và tương tác với thụ thể của đại thực bào để bắt đầu phản ứng với vật chủ tiền viêm (Hình 4D). Mức mRNA của Tlr4 và Cd14, một cơ quan thụ cảm cốt lõi có chức năng với TLR4 để phát hiện LPS, đã được điều chỉnh trong gan của những con chuột được điều trị bằng CCl4 tiếp xúc với ethanol (Hình 4E và 4F). Điều thú vị là việc điều trị bằng Sulforaphane đã làm giảm hiệu quả sự gia tăng quan sát được, cho thấy rằng Sulforaphane có thể làm giảm sự phơi nhiễm LPS ở gan (Hình. 4D-4F). Trong bối cảnh này, nồng độ mRNA ở gan của các cytokine tiền viêm, bao gồm yếu tố hoại tử khối u α (Tnfa), interleukin 1 b (Il1b) và phối tử chemokine 2 (Ccl2), đã tăng lên đáng kể ở những con chuột được điều trị bằng CCl4 tiếp xúc với ethanol trong khi điều trị bằng Sulforaphane dẫn đến sự ngăn chặn đáng kể những thay đổi này được quan sát thấy ở những con chuột được điều trị bằng CCl4 tiếp xúc với ethanol (Hình. 4G-4I). Những kết quả này chỉ ra rằng Sulforaphane có khả năng làm giảm bớt tình trạng viêm gan thông qua việc ức chế con đường truyền tín hiệu LPS / TLR4 cũng như ức chế stress oxy hóa.
2.4. Sulforaphane ức chế sự xơ hóa gan ở những con chuột được điều trị bằng CCl4 tiếp xúc với ethanol
Dựa trên các hoạt động chống oxy hóa và chống viêm quan sát được của Sulforaphane, chúng tôi đã đánh giá tác động của nó đối với sự phát triển của xơ hóa gan. Tiêu thụ ethanol mãn tính làm trầm trọng thêm sự phát triển của xơ hóa gan ở những con chuột được điều trị bằng CCl4, được xác định bằng phương pháp nhuộm Sirius Red, trong khi điều trị bằng Sulforaphane dẫn đến sự cải thiện đáng kể tình trạng xơ hóa gan được quan sát thấy ở những con chuột này (Hình 5A).
Phân tích bán định lượng xác định rằng điều trị bằng Sulforaphane dẫn đến giảm khoảng 50% các khu vực có thay đổi sợi trong gan của những con chuột được điều trị CCl4 tiếp xúc với ethanol (Hình 5B). Chúng tôi cũng thực hiện phân tích mô miễn dịch của các mẫu nhuộm α-SMA để kiểm tra sự hoạt hóa của HSC, đóng vai trò quan trọng trong quá trình hình thành sợi gan. Cùng với sự suy giảm xơ hóa được quan sát thấy, các khu vực dương tính với α-SMA đã giảm đáng kể ở nhóm được điều trị bằng Sulforaphane so với nhóm được điều trị bằng phương tiện trong số những con chuột được điều trị bằng CCl4 tiếp xúc với ethanol (Hình 5A và 5C). Sự ức chế xơ gan qua trung gian Sulforaphane cũng có thể quan sát được đồng thời với sự suy giảm nồng độ mRNA ở gan của các gen nhân xơ bao gồm Acta2, Tgfb1 và Col1a1 (Hình. 5D).
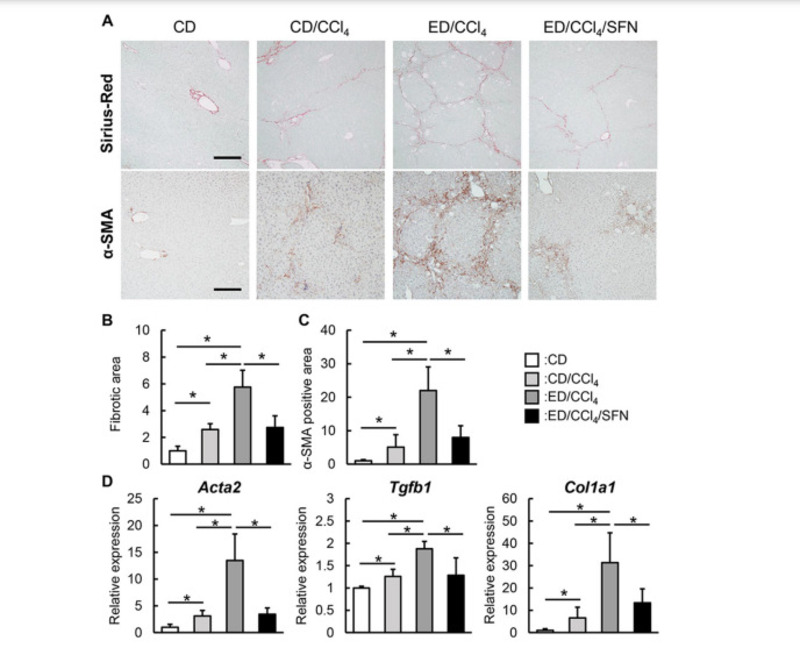
Hình 5. Ảnh hưởng của sulforaphane đối với sự phát triển xơ hóa gan ở chuột gây ra bởi ethanol cộng với CCl4. (A) Ảnh vi mô đại diện của các phần gan được nhuộm bằng SiriusRed và α-SMA. Thanh tỷ lệ; 50 μm. (B và C) Định lượng bán phần của (B) vùng xơ sợi nhuộm màu đỏ Sirius và (C) vùng dương tính với miễn dịch α-SMA trong trường công suất cao (HPF) bằng phần mềm NIH ImageJ. (D) Mức độ biểu hiện mRNA tương đối của Acta2, Tgfb1 và Col1a1 trong gan của chuột thí nghiệm. Mức độ biểu hiện mRNA được đo bằng qRT-PCR và Gapdh được sử dụng làm kiểm soát nội bộ cho qRT-PCR. Các giá trị định lượng được chỉ ra dưới dạng các thay đổi gấp đối với các giá trị của nhóm CD (B-D). Dữ liệu là trung bình ± SD (n = 10), ∗ P <0,05, ∗∗ P <0,01, cho thấy sự khác biệt đáng kể giữa các nhóm (B-D).
2.5. Sulforaphane ức chế hoạt động tạo tiền bào qua trung gian LPS và sản xuất ROS trong tế bào LX-2
LPS đóng một vai trò quan trọng trong sự phát triển của xơ hóa gan do rượu thông qua việc kích hoạt con đường tín hiệu TLR4 / NF-κB trong HSC. Vì vậy, cuối cùng chúng tôi đã kiểm tra tác động của Sulforaphane đối với sự hoạt hóa HSC qua LPS. Như thể hiện trong Hình 6A, việc xử lý các tế bào LX-2 với LPS làm tăng quá trình phosphoryl hóa NF-κB, cho thấy sự kích hoạt TLR4. Đáng chú ý, điều trị bằng Sulforaphane ức chế quá trình phosphoryl hóa NF-κB do LPS gây ra (Hình 6A). Sau đó, chúng tôi đánh giá tác động của việc ức chế tín hiệu TLR4 qua trung gian Sulforaphane đối với hoạt động tạo sợi trong tế bào LX-2. Phù hợp với các báo cáo trước đó, LPS đã điều chỉnh giảm đáng kể mức độ biểu hiện mRNA của protein hình thái xương và chất ức chế liên kết màng activin (BAMBI), một thụ thể giả TGF-β, trong tế bào LX-2 (Hình 6B). Điều quan trọng là, điều trị bằng Sulforaphane làm giảm sự giảm biểu hiện mRNA BAMBI qua trung gian LPS theo cách phụ thuộc vào liều lượng (Hình 6B). Hơn nữa, LPS làm tăng cảm ứng qua trung gian TGF-β1 của COL1A1 và ACTA2, vốn bị suy giảm khi điều trị bằng Sulforaphane, phù hợp với sự gia tăng biểu hiện mRNA BAMBI (Hình 6C). Chúng tôi cũng đã kiểm tra tác động của Sulforaphane đối với các thành viên họ gen NOX, bao gồm NOX1, NOX2 và NOX4, có liên quan đến stress oxy hóa ở HSC. Điều trị bằng LPS gây ra mức mRNA của NOX1 và NOX4 mà không quan sát thấy sự thay đổi ở mức mRNA NOX2 (Hình 6D – 6F). Ngược lại, Sulforaphane làm giảm đáng kể sự điều tiết của NOX1 và NOX4 (Hình 6D và 6F). Những kết quả này chỉ ra rằng Sulforaphane có thể ức chế hoạt động tạo sợi sinh dục do LPS gây ra cũng như sản xuất ROS có nguồn gốc NOX trong HSC.
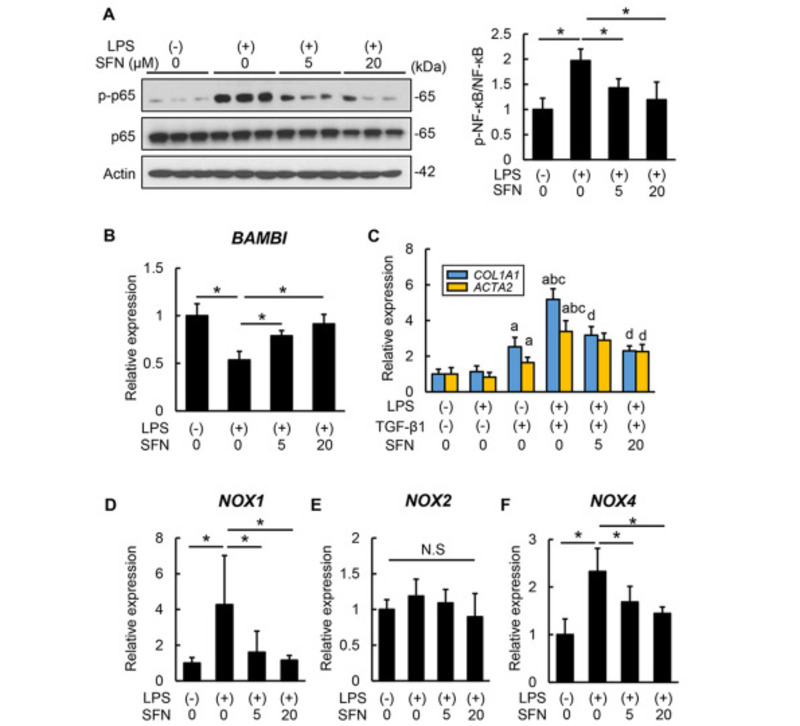
Hình 6. Ảnh hưởng của sulforaphane đối với sự hoạt hóa HSC được kích thích bằng LPS trong ống nghiệm. (A) Western blots cho quá trình phosphoryl hóa NF-κB p65 trong LX-2 (bảng bên trái) và tốc độ phosphoryl hóa định lượng của NF-κB / NF-κB đã được phosphoryl hóa (bảng bên phải). Actin đã được sử dụng làm kiểm soát tải. (B) Mức độ biểu hiện mRNA tương đối của BAMBI trong tế bào LX-2. (C) Ảnh hưởng của sulforaphane (SFN) lên sự biểu hiện mRNA của ACTA2 và COL1A1 trong tế bào LX-2 được kích thích bằng lipopolysaccharide (LPS) và TGF-β1. (D-F) Ảnh hưởng của SFN lên các biểu hiện mRNA của (D) NOX1, (E) NOX2 và (F) NOX4 trong các tế bào LX-2 được LPS kích thích. Tế bào được nuôi cấy với LPS (O55: B5, 100 ng / mL) và / hoặc SFN (0, 5 và 20 μM) trong 12 giờ (A), hoặc 6 giờ (B và DF), hoặc LPS (O55: B5, 100 ng / mL) và / hoặc TGF-β1 của người tái tổ hợp (5ng / mL) và / hoặc SFN (0, 5 và 20 μM) trong 6 giờ (C). Mức độ biểu hiện mRNA được đo bằng qRT-PCR và GAPDH được sử dụng làm kiểm soát nội bộ cho qRT-PCR. Tốc độ phosphoryl hóa định lượng là sự thay đổi gấp đối với các nhóm không điều trị (A-F). Dữ liệu có giá trị trung bình ± SD (n = 8), ∗ P <0,05, cho thấy sự khác biệt đáng kể giữa các nhóm (A, B và D-F). aP <0,05, bP <0,05, cP <0,05 và dP <0,05 so với nhóm được xử lý bằng LPS (-) / TGF-β1 (-) / SFN 0 μM, LPS (+) / TGF-β1 ( -) / SFN 0 μM, LPS (-) / TGF-β1 (+) / SFN 0 μM, LPS (+) / TGF-β1 (+) / SFN 0 μM, tương ứng (C).
3. Kết luận

Trong nghiên cứu này, chúng tôi đã chứng minh rằng chất kích hoạt Nrf2 Sulforaphane làm giảm hiệu quả sự tiến triển của xơ gan do tiếp xúc với ethanol ở những con chuột được điều trị bằng CCl4. Chúng tôi đề xuất rằng tác dụng chống xơ hóa do Sulforaphane quan sát được có liên quan đến một số cơ chế cơ bản.
Đầu tiên chúng tôi nghiên cứu tác động của Sulforaphane lên hoạt động ALDH2, chất này chịu trách nhiệm chuyển hóa acetaldehyde trong tế bào HepaRG, vì sự tích tụ acetaldehyde là một trong những yếu tố làm trầm trọng thêm sự phát triển của bệnh xơ hóa liên quan đến ALD. Hoạt động ALDH2 được tăng cường Sulforaphaneen theo cách thức phụ thuộc vào liều lượng song song với việc cảm ứng các gen mục tiêu Nrf2, và phân tích theo thời gian cho thấy rằng sự tăng cường này không xảy ra ngay lập tức.
Những kết quả này cho thấy rằng Sulforaphane gây ra hoạt động ALDH2 gián tiếp thông qua cơ chế phiên mã trong tế bào HepaRG. Điều quan trọng là, điều trị bằng Sulforaphane làm giảm đáng kể nồng độ acetaldehyde trong gan song song với biểu hiện và hoạt động ALDH2 cao hơn ở những con chuột tiếp xúc với ethanol mãn tính mà không ảnh hưởng đến sự hấp thụ ethanol qua ruột.
Hơn nữa, một nghiên cứu gần đây đã báo cáo rằng Sulforaphane có tác dụng tương tự trên một đường u gan ở chuột biểu hiện cả ALDH2 và ADH. Những phát hiện này ủng hộ mạnh mẽ kết quả của chúng tôi rằng Sulforaphane thúc đẩy chuyển hóa acetaldehyde trong gan. Chúng tôi cũng chứng minh rằng Sulforaphane có thể trực tiếp ngăn chặn sự gia tăng của HSC ở người và sự hoạt hóa qua trung gian acetaldehyde thông qua kích hoạt phiên mã Nrf2. Nhiều nghiên cứu đã chỉ ra rằng acetaldehyde gây ra sự tăng sinh và hoạt hóa HSC thông qua nhiều cơ chế khác nhau.
Mặt khác, Sulforaphane cũng có thể ngăn chặn quá trình xơ hóa gan do ligationin gây ra trong ống mật ở chuột bằng cách điều chỉnh sự ức chế qua trung gian Nrf2 đối với con đường tín hiệu TGF-β / Smad trong HSCs. Sulforaphane có thể ức chế sự hoạt hóa HSC thông qua sự điều hòa giảm của miR-423-5p trong tế bào LX-2, cản trở sự hoạt hóa của chúng.
Những bằng chứng này phù hợp với các phát hiện nghiên cứu hiện tại và chứng minh rằng Sulforaphane không chỉ góp phần làm giảm sự tích tụ acetaldehyde ở gan mà còn giúp bảo vệ trực tiếp HSC khỏi sự tăng sinh do acetaldehyde và hoạt động tạo sợi.
Nói chung, bài nghiên cứu này chỉ ra rằng chất kích hoạt Nrf2 Sulforaphane có tác dụng bảo vệ sự phát triển của bệnh xơ hóa liên quan đến ALD ở mô hình chuột bị xơ hóa gan do ethanol cộng với CCl4. Tác dụng chống xơ hóa này của Sulforaphane dựa trên các chức năng điều hòa đa chức năng của nó bao gồm cảm ứng hoạt động ALDH2 và thúc đẩy chuyển hóa acetaldehyde, bảo vệ HSC khỏi hoạt động tạo sợi do acetaldehyde gây ra, ức chế peroxy hóa lipid phụ thuộc CYP2E1, giảm phơi nhiễm LPS ở gan và thâm nhập đại thực bào, và giảm tính nhạy cảm của HSC với TGF-β do ức chế hoạt hóa TLR4. Là một chất phytochemical với độc tính hạn chế, Sulforaphane cuối cùng có thể nổi lên như một lựa chọn điều trị mới cho bệnh nhân xơ hóa liên quan đến ALD.
4. Các chủ đề liên quan
Dưới đây là một số bài viết về các chủ đề nghiên cứu có liên quan đến hoạt chất Sulforaphane và công dụng của chúng:
- Tác dụng của Sulforaphane khi tập luyện sức đề kháng nặng
- Sulforaphane làm giảm căng thẳng oxy hóa và tình trạng viêm
- Sulforaphane cải thiện rối loạn chức năng nhận thức sau phẫu thuật
5. Tham vấn chuyên môn
- Bác sĩ
- Nguồn tham khảo: https://www.sciencedirect.com/science/article/abs/pii/S0955286320306057

