- Chất dạng hạt mịn: Thông tin nghiên cứu
- Tổng quan
- 1. Giới thiệu về nghiên cứu
- 2. Nguyên liệu và phương pháp
- 2.1. Phương pháp thu thập và tiền xử lý PM2.5
- 2.2. Phương pháp nuôi cấy tế bào
- 2.3. Đặc tính của PM2.5
- 2.4. Đo lường khả năng sống của tế bào
- 2.5. Đo lường sự giải phóng lactate dehydrogenase (LDH)
- 2.6. Xác định hàm lượng malondialdehyde (MDA)
- 2.7. Xác định các loại oxy phản ứng (ROS)
- 2.8. Đánh giá quá trình chết của tế bào
- 2.9. Đánh giá các cytokine gây viêm
- 2.10. Phương pháp Western blot
- 2.11. Phân tích thống kê
- 3. Các kết quả
- 3.1. Đặc điểm và thành phần hóa học của PM2.5
- 3.2. Ảnh hưởng của PM2.5 và Sulforaphane đến khả năng tồn tại của tế bào HBE
- 3.3. Sulforaphane làm giảm bớt căng thẳng oxy hóa do PM2.5 gây ra
- 3.4 . Ảnh hưởng của Sulforaphane đối với quá trình chết rụng tế bào do PM2.5 gây ra
- 3.5. Sulforaphane làm giảm bớt tình trạng viêm do PM2.5 gây ra
- 3.6. Sulforaphane làm giảm các tổn thương do oxy hóa thông qua việc kích hoạt con đường chống oxy hóa Nrf2 / Keap1
- 4. Thảo luận thêm về công dụng của Sulforaphane trong việc giảm độc tố của PM2.5
- 5. Kết luận
- 4. Các chủ đề liên quan
- 5. Tham vấn chuyên môn
Chất dạng hạt mịn: Thông tin nghiên cứu
Từ khóa:
- PM2.5
- Sulforaphane
- Tế bào biểu mô phế quản ở người
- Chất chống oxy hóa viêm
Tổng quan
Chất dạng hạt mịn PM2.5 có thể gây hại trực tiếp đến phổi và ảnh hưởng đến sức khỏe tổng thể của con người trên toàn thế giới. Độc tính của PM2.5 được thể hiện rõ ràng nhất ở tình trạng căng thẳng và viêm nhiễm do oxy hóa. Sulforaphane, một hợp chất tự nhiên có sẵn trong thực vật chủ yếu có nguồn gốc từ các loại rau họ cải đã được chứng minh rộng rãi là có khả năng chống oxy hóa và chống viêm. Chính vì thế, mục tiêu của nghiên cứu này là đánh giá tác dụng bảo vệ của Sulforaphane trong việc chống lại các tổn thương do PM2.5 gây ra trong các tế bào biểu mô phế quản (HBE) ở người và điều tra các đặc tính sinh lý của PM2.5. Kết quả cho thấy PM2.5 chủ yếu là các hạt mịn có nhiều trong các kim loại chuyển tiếp và PAH, một phần nguyên nhân dẫn đến việc tạo ra dư thừa các loại oxy phản ứng (ROS). Hơn nữa, tiếp xúc với PM2.5 còn có thể dẫn đến tổn thương oxy hóa và gây ra phản ứng viêm trong tế bào. Tuy nhiên, tiền xử lý với Sulforaphane đã làm giảm đáng kể những tác động tiêu cực này thông qua con đường liên quan đến yếu tố hạt nhân E2 yếu tố 2 / yếu tố đáp ứng chống oxy hóa (Nrf2 / ARE). Nói chung, những phát hiện này chứng minh rằng việc tiền xử lý bằng Sulforaphane có thể cải thiện tổn thương tế bào do PM2.5 gây ra thông qua việc ức chế căng thẳng oxy hóa và viêm trong tế bào HBE.

1. Giới thiệu về nghiên cứu
Trong những năm gần đây, ô nhiễm không khí đang liên tục đe dọa nghiêm trọng đến sức khỏe con người trên toàn thế giới. Vào năm 2013, trên 87% dân số được đánh giá là đang sống trong môi trường có chất lượng không khí không đáp ứng các hướng dẫn của Tổ chức Y tế Thế giới (WHO) (Limb, 2016). Hơn nữa, theo gánh nặng bệnh tật toàn cầu được tiến hành vào năm 2015, ô nhiễm không khí chủ yếu là do PM2.5 (đường kính trung bình <2,5 μm), dẫn đến 3,3 triệu ca tử vong sớm mỗi năm trên khắp thế giới (Brauer và cộng sự, 2016). Trong số sáu tiêu chí ô nhiễm trong ô nhiễm không khí, ô nhiễm vật chất dạng hạt được điều tra rộng rãi nhất liên quan đến khả năng hoạt động như một chất vận chuyển vật lý để vận chuyển các chất độc hại khác (Ning và cộng sự, 2018). Vật chất dạng hạt thường được phân loại thành PM10 và PM2.5 theo Cơ quan Bảo vệ Môi trường Hoa Kỳ (USEPA). So với PM10, PM2.5 nhỏ hơn nhiều và có nhiều diện tích bề mặt hơn về tổng khối lượng và có thể hấp thụ nhiều chất độc hại hơn các hạt trong không khí bằng lăng khác (Oberdörster, Ferin, Gelein, Soderholm, & Finkelstein, 1992). Do đó, PM2.5 có thể xâm nhập vào phổi và đi đến tận phế nang, mang các thành phần có hại đến hệ tuần hoàn (Whyand, Hurst, Beckles, & Caplin, 2018). Tiếp xúc cấp tính và mãn tính với các chất dạng hạt mịn đều tạo thành những thiệt hại cho sức khỏe của chúng ta như các kết quả bất lợi đối với hệ hô hấp, hệ tim mạch, cảm ứng và làm trầm trọng thêm bệnh đái tháo đường týp II (Ông và cộng sự, 2017, Yin và cộng sự, 2017).

Nhiều nghiên cứu đã chứng minh rằng căng thẳng oxy hóa và viêm đóng vai trò quan trọng tạo nên độc tính của PM2.5 (Bo et al., 2016). Cùng với đó, các can thiệp dinh dưỡng như bổ sung chế độ ăn uống được coi là một cách tiếp cận đầy hứa hẹn để chống lại độc tính hóa học môi trường trong tương lai gần. Chính vì vậy, các nhà nghiên cứu đã thí nghiệm một số hóa chất thực vật cụ thể hoặc thuốc có khả năng chống oxy hóa hoặc chống viêm để giảm bớt tính độc hại của PM2.5 đối với sức khỏe con người (Hyun và cộng sự, 2019 , Romieu và cộng sự, 2008).
Sulforaphane (SFN), có nhiều trong mầm bông cải xanh, cải bắp và các loại rau họ cải khác, thuộc nhóm Isothiocyanate của các hợp chất Organosulfur. Nó được sản xuất bằng enzym qua sự xúc tác Glucoraphaninthành Sulforaphane (Dinkova-Kostova, Fahey, Kostov, & Kensler, 2017). Tích lũy bằng chứng đã chứng minh rằng Sulforaphane có công dụng chống khối u, chống oxy hóa và chống viêm (Guerrero-Beltrán, Calderón-Oliver, Pedraza-Chaverri, & Chirino, 2012). Tuy nhiên, những khả năng này và các cơ chế liên quan chưa bao giờ được báo cáo trong việc ngăn ngừa các tác động tiêu cực đến sức khỏe do PM2.5 gây ra trong tế bào HBE.
Trong nghiên cứu này, các mẫu PM2.5 ở Wuxi được thu thập liên tục từ tháng 6 năm 2017 đến tháng 12 năm 2018. Để điều tra những tác động có hại đến đường hô hấp của con người do PM2.5 gây ra, tế bào HBE đã được lấy làm mô hình đường thở tiếp xúc với PM2.5. Hơn nữa, để điều tra xem việc xử lý trước bằng Sulforaphane có thể chống lại các tác động bất lợi do PM2.5 gây ra hay không, các tế bào HBE đã được xử lý bằng hoặc không có Sulforaphane và sau đó được ủ với PM2.5 trong một thời gian cụ thể. Sau đó, một loạt các chỉ số sinh hóa bao gồm khả năng sống của tế bào, giải phóng lactate dehydrogenase (LDH), hàm lượng malondialdehyde (MDA), ROS mức độ, quá trình chết rụng tế bào và các cytokine gây viêm sẽ được đo lường và đánh giá. Mục tiêu của nghiên cứu này là tìm hiểu tác dụng bảo vệ của Sulforaphane chống lại các tổn thương do PM2.5 gây ra trong mô hình tế bào, cũng như các thành phần hóa học và đặc điểm hình thái của các hạt PM2.5.
2. Nguyên liệu và phương pháp
2.1. Phương pháp thu thập và tiền xử lý PM2.5

Các mẫu không khí được thu thập trên bộ lọc sợi thủy tinh (GE Healthcare Inc., Chicago, IL, Hoa Kỳ) từ tháng 6 năm 2017 đến tháng 12 năm 2018 với bộ thu TH-1000H PM2.5 (Wuhan Tianhong Instruments Co., Ltd., Vũ Hán, Trung Quốc) vận hành ở 1,05 m 3 / phút và máy lấy mẫu khối lượng thấp do Airmetrics sản xuất (AirMetrics Inc., Eugene, OR, USA) hoạt động ở 5 L / phút cho 24 ha ngày. Thiết bị thu gom được đặt trên nóc tòa nhà Phòng thí nghiệm trọng điểm của Nhà nước về Khoa học và Công nghệ Thực phẩm (Vô Tích, Trung Quốc) (vĩ độ 31 ° 28’N, kinh độ 120 ° 16’E), nơi không có nguồn ô nhiễm rõ ràng nào gần đó. Sau khi thu thập xong, các bộ lọc tải các chất hạt mịn được bảo quản ở nhiệt độ -20 ° C để nghiên cứu thêm. Bộ lọc được cắt thành 1 × 1 cm 2mảnh và tràn vào nước khử ion. Các huyền phù nước được ngâm trong 3 × 15 phút và đi qua gạc tám lớp và được đông khô trong chân không. Các hạt PM2.5 được cân và bổ sung với dung dịch muối đệm photphat (PBS, pH7,0, 0,01 M) để có được nồng độ cuối cùng là 20 mg / mL. Giải pháp ban đầu là chiếu tia cực tím để tránh nội độc tố. Trước khi thử nghiệm, dung dịch gốc PM2.5 được pha loãng với môi trường Eagle đã sửa đổi của Dulbecco có bổ sung 10% huyết thanh bò thai và được ngâm trong 20 phút để thu được dung dịch đồng nhất.
2.2. Phương pháp nuôi cấy tế bào
Tế bào biểu mô phế quản của con người được lấy từ Cơ sở hạ tầng của Nguồn tế bào Trung Quốc (Bắc Kinh, Trung Quốc). Tế bào được nuôi cấy ở 37 ° C với 5% CO2 trong môi trường Eagle đã sửa đổi của Dulbecco (chứa phenol đỏ) (GE Healthcare Inc., Chicago, IL, USA) được bổ sung 10% huyết thanh bò thai (Gibco, Life Technologies Co., Grand Island, NY, USA) và 1% penicillin / streptomycin (Gibco, Life Technologies Co., Grand Island, NY, USA).
2.3. Đặc tính của PM2.5
Đặc điểm của PM2.5 bao gồm hình thái vi mô, đường kính trung bình, các nguyên tố kim loại, các ion hòa tan trong nước và các hydrocacbon thơm đa vòng (PAHs). Vì hình thái và thành phần hóa học của PM2.5 bị ảnh hưởng bởi nhiều yếu tố, một phần bộ lọc đại diện được thu thập vào mùa đông 2018 đã được sử dụng trong các cuộc điều tra sau đây. Nổi bật trong số đó là hình thái vi mô được khảo sát bằng kính hiển vi điện tử quét phát xạ trường lạnh (CFE-SEM) (Công ty TNHH Hitachi, Tokyo, Nhật Bản). Ngoài ra, Sự tán xạ ánh sáng động (Malvern Panalytical Co. Ltd., Royston, Vương quốc Anh) đã được áp dụng để khảo sát sự phân bố kích thước của các mẫu PM thu thập được. Kính hiển vi điện tử quét kết hợp với quang phổ tia X phân tán năng lượng(SEM-EDX) (Công ty TNHH Hitachi, Tokyo, Nhật Bản) được sử dụng để khảo sát các yếu tố của bề mặt mẫu. Để xác định nồng độ của các nguyên tố kim loại trong các mẫu PM, người ta đã thu được phép đo phổ phát xạ quang plasma cảm ứng (ICP-OES) (PerkinElmer Inc., Waltham, MA, USA). Sắc ký ion(IC) (Dionex Inc., Sunnyvale, CA, USA) và sắc ký khí – khối phổ riêng biệt (GC – MS) (Shimadzu Inc., Kyoto, Nhật Bản) đã được áp dụng để khảo sát nồng độ của các ion hòa tan trong nước và nồng độ của các nguyên tố kim loại tương ứng. Tóm lại, quá trình tiền xử lý và xử lý các nguyên tố kim loại, các ion hòa tan trong nước và các hydrocacbon thơm đa vòng được thực hiện theo các tiêu chuẩn quốc gia của Trung Quốc (HJ 657-2013, HJ 799-2016 và HJ 646-2013).
2.4. Đo lường khả năng sống của tế bào
Khả năng sống của tế bào được đo bằng CCK-8 (phòng thí nghiệm Dojindo, Kumamoto, Nhật Bản) theo hướng dẫn của nhà sản xuất. Tế bào được gieo hạt trong đĩa 96 giếng với mật độ 1.000 tế bào mỗi giếng. Sau khi ủ trong 24 giờ, các tế bào được rửa sạch và ủ với PM2.5 hoặc Sulforaphane (Sigma-Aldrich Co. Ltd., St. Louis, MO, USA) trong thời gian cụ thể. Sau đó, các tế bào sống được nhuộm bằng dung dịch CCK-8 10% và ủ trong 2 giờ. Độ hấp thụ được đo ở bước sóng 450 nm bằng đầu đọc vi tấm (Bio-Rad Laboratories Inc., Hercules, CA, Hoa Kỳ) ở nhiệt độ phòng.
2.5. Đo lường sự giải phóng lactate dehydrogenase (LDH)
Sự giải phóng lactate dehydrogenase được xác định bằng một bộ công cụ thương mại (Viện Công nghệ Sinh học Beyotime, Thượng Hải, Trung Quốc). Tóm lại, sau khi xử lý bằng PM2.5, phần nổi phía trên của môi trường tế bào được thu thập và xét nghiệm theo hướng dẫn của nhà sản xuất.
2.6. Xác định hàm lượng malondialdehyde (MDA)
Hàm lượng malondialdehyde được xác định bằng bộ xét nghiệm thương mại (Viện Công nghệ Sinh học Beyotime, Thượng Hải, Trung Quốc). Tế bào được thu hoạch và tái huyền phù trong dung dịch đệm ly giải. Sau khi ly tâm ở 12.000 g trong 10 phút, phần nổi của dịch bào được thu thập và xác định theo hướng dẫn của nhà sản xuất.
2.7. Xác định các loại oxy phản ứng (ROS)

Các loại oxy phản ứng được phát hiện bằng cách sử dụng một đầu dò huỳnh quang dichloro-dihydro-fluorescein diacetate (DCFH-DA) được lấy từ Viện Công nghệ Sinh học Beyotime (Thượng Hải, Trung Quốc). Để nạp đầu dò huỳnh quang vào tế bào, môi trường ban đầu được loại bỏ và tế bào được ủ với DCFH-DA đã được pha loãng trước đó với môi trường không có huyết thanh ở 37 ° C trong 20 phút. Sau khi ủ, các tế bào được rửa hai lần và được khảo sát bằng cách sử dụng phương pháp phân tích đo lưu huỳnh. Định lượng ROS được thực hiện bằng cách sử dụng đầu đọc vi tấm huỳnh quang (PerkinElmer Inc., Waltham, MA, USA) với bước sóng kích thích ở 488 nm và bước sóng phát xạ ở bước sóng 525 nm. Mức độ ROS trong mỗi giếng được bình thường hóa ở nhóm đối chứng (100%). Đồng thời, sự phát sinh ROS trong tế bào được quan sát và ghi lại bằng kính hiển vi huỳnh quang (Carl Zeiss Inc., Oberkochen, Đức).
2.8. Đánh giá quá trình chết của tế bào
Quá trình tự chết của tế bào được phát hiện dựa trên Bộ công cụ phát hiện quá trình tự chết của Annexin V- FITC (Viện Công nghệ sinh học Beyotime, Thượng Hải, Trung Quốc). Sau khi tiếp xúc với PM2.5, tế bào được thu hoạch, đếm và sau đó nhuộm bằng chất huỳnh quang isothiocyanate (FITC) và propidium iodide (PI). Sau khi ủ trong bóng tối ở nhiệt độ phòng trong 20 phút, quá trình apoptosis của tế bào được phân tích bằng phương pháp đo tế bào dòng chảy (BD Life Sciences Co. Ltd., San Jose, CA, USA). Tỷ lệ apoptosis được tính toán bởi FlowJo (phiên bản 10.0, Công ty TNHH Khoa học Đời sống BD, San Jose, CA, Hoa Kỳ).
2.9. Đánh giá các cytokine gây viêm
Mức độ IL-6 và IL-8 trong phần nổi của môi trường nuôi cấy sau khi tiếp xúc với PM2.5 được đánh giá bằng bộ xét nghiệm hấp thụ miễn dịch liên kết enzym (ELISA) mua từ Công ty Công nghệ sinh học Beyotime (Thượng Hải, Trung Quốc). Một cách ngắn gọn, môi trường nuôi cấy tế bào được ly tâm ở 500 g trong 5 phút. Phần nổi phía trên được thu thập và xác định theo hướng dẫn của nhà sản xuất.
2.10. Phương pháp Western blot
Protein hạt nhân và protein tế bào chất được chiết xuất bằng một bộ dụng cụ chiết xuất thương mại của Công ty Công nghệ sinh học Sangon (Thượng Hải, Trung Quốc). Nồng độ protein được đo bằng bộ xét nghiệm protein BCA mua từ Công ty Công nghệ sinh học Beyotime (Thượng Hải, Trung Quốc). Sau đó, các protein được tách ra bằng cách sử dụng gel điện di 10% natri dodecylsulfate – polyacrylamide. Sự chuyển ẩm và nitrocellulosemàng (Millipore, Billerica, MA, USA) đã được sử dụng để cho phép protein chuyển từ gel sang màng. Được chặn bằng sữa không béo 5%, các màng được ủ với các kháng thể chính:
- kháng Nrf2 đa dòng của thỏ (mèo. 16396–1 ‐ AP)
- kháng Histon H3 (mèo. 17168–1 ‐ AP)
- chống HO-1 (cat. No. 10701–1 ‐ AP) từ Công ty Công nghệ Sinh học ProteinTech Group (Vũ Hán, Trung Quốc)
- chuột đơn dòng chống ACTB (cat. No. D191047) từ Công ty Công nghệ Sinh học Sangon (Thượng Hải, Trung Quốc).
Quá trình ủ với các kháng thể sơ cấp được giữ ở 4 ° C qua đêm. Các kháng thể thứ cấp được mua từ Công ty Công nghệ Sinh học Sangon (Thượng Hải, Trung Quốc): IgG liên hợp dê chống peroxidase ‐ từ cải ngựa (cat. No. D110087) và IgG dê liên hợp với dê kháng peroxidase Horseradish (cat. No. D110058), thuốc thử phát quang hóa học (Beyotime, Thượng Hải, Trung Quốc) và bị thu giữ bởi FluorChem FC3 (Công ty Công nghệ sinh học ProteinSimple, San Jose, CA, Hoa Kỳ)
2.11. Phân tích thống kê
Phân tích thống kê được thực hiện bằng phần mềm SPSS 21.0 (SPSS Inc., Chicago, IL, USA). Dữ liệu thu được từ ba thí nghiệm độc lập được biểu thị bằng trung bình ± độ lệch (SD). Phân tích phương sai một chiều (ANOVA) theo sau là thử nghiệm nhiều phạm vi của Duncan đã được thực hiện để kiểm tra ý nghĩa giữa các nhóm. Giá trị p <0,05 được coi là có ý nghĩa thống kê. Phân tích tương quan được thực hiện bằng cách sử dụng mô hình hồi quy tuyến tính trong phần mềm R v.3.5.3 ( R Foundation for Statistical Computing, Vienna, Austria).
3. Các kết quả
3.1. Đặc điểm và thành phần hóa học của PM2.5
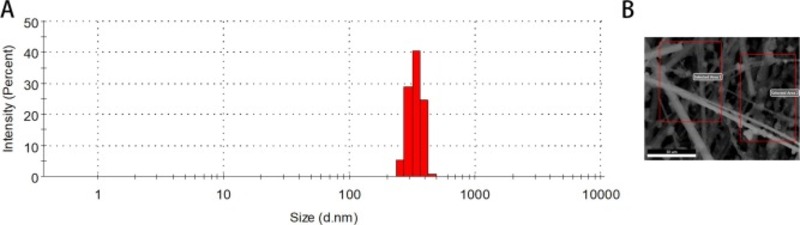
Hình thái và đường kính trung bình của các mẫu thu thập được phân tích bằng SEM. Như trong Hình 1 A, bộ lọc sợi thủy tinh được cấu tạo bởi các mạng sợi xoắn và dày đặc. Hình 1 B-D trình bày một loạt các hình ảnh phóng to của các mẫu đại diện trong SEM, cho thấy rằng phần lớn các mẫu PM2.5 thu thập được dường như là các hình dạng vô định hình với đường kính trung bình dưới 500 nm.
Những hình ảnh này cũng cho thấy một số hạt nhỏ có xu hướng bám chặt vào sợi thủy tinh và tập hợp lại để tạo thành các hạt lớn. Đáng chú ý, Hình 1 E-F chỉ ra rằng một prat của các mẫu PM2,5 có hình dạng bình thường. Trong khi đó, tán xạ ánh sáng động đã được áp dụng để xác nhận sự phân bố kích thước của các mẫu trong huyền phù. Kết quả chỉ ra rằng các mẫu PM có dải kích thước 300–350 nm (Hình 2 A), phù hợp với kết quả SEM.
Như thể hiện trong Hình 2 B và Bảng 1, bên cạnh Si và O từ bộ lọc sợi thủy tinh và vỏ trái đất, kết quả phân tích sơ bộ SEM-EDX cho thấy C là nguyên tố có nhiều nhất trong các mẫu, chiếm 58,86% trọng lượng nguyên tố còn lại. Ngoài ra, Na, K, Zn, Ca, S và các kim loại chuyển tiếp như Fe, Cu cũng được phát hiện lần lượt chiếm 11,83%, 8,45%, 6,02%, 2,07%, 0,82%, 4,75% và 2,37%.
ICP-OES được tiến hành để nghiên cứu sâu hơn về thành phần và nồng độ của các nguyên tố kim loại trong mẫu. Kết quả từ ICP-OES cho thấy các nguyên tố lớp vỏ bao gồm K, Fe, Na, Ca, Al và Mg chiếm gần 81% tổng số nguyên tố kim loại (Bảng 2). Trong số các nguyên tố từ nguồn nhân tạo, Zn có nhiều nhất, chiếm 8,55% tổng số nguyên tố kim loại (Bảng 2).
Bên cạnh các nguyên tố kim loại, PAHs là một yếu tố quan trọng khác góp phần vào khả năng gây độc của PM2.5. Bảng 2 cũng liệt kê 16 loại PAH được tìm thấy trong các mẫu không khí. Trong số đó, acenaphthylene và acenaphthene có mặt chủ yếu, chiếm 49,65% tổng số PAH. Anthracene không được phát hiện trong các mẫu. Các ion hòa tan trong nước được xác định bằng IC. Như mô tả trong Bảng 2 , SO 4 2− có nồng độ cao nhất, chiếm 20,47 ± 8,26 ng / m 3. Nồng độ của NH 4 + , Cl – và NO 3 -lần lượt là 9,68 ± 1,31, 3,85 ± 1,79 và 12,69 ± 5,81 ng / m 3.
Hình 1. Ảnh SEM của các mẫu PM2.5 dưới các độ phóng đại khác nhau (A) Thanh tỷ lệ 50,0 μm (B) Thanh tỷ lệ 10,0 μm (C) Thanh tỷ lệ 3,00 nm (D) Thanh tỷ lệ 2,00 nm (E) Thanh tỷ lệ 5,00 nm (F) Thanh tỷ lệ 2,00 nm.

Hình 2. Sự phân bố kích thước của các mẫu được thu thập trong huyền phù và hình thái vi mô của các khu vực được chọn để phân tích SEM-EDX.
Bảng 1. Các nguyên tố và nồng độ trung bình (so với nguyên tố K) của các khu vực đã chọn của PM2.5.
| Yếu tố | Trọng lượng % | % Nguyên tử | Tỷ lệ nhập ròng |
| O | 33,91 | 37.47 | 596,9 |
| C | 28,76 | 42.32 | 210.11 |
| Si | 17,23 | 10,85 | 1774,56 |
| Na | 5,78 | 4,45 | 233,16 |
| K | 4,13 | 1,92 | 178,13 |
| Zn | 2,94 | 0,8 | 56,99 |
| Fe | 2,32 | 0,63 | 61.48 |
| Al | 2,12 | 1,39 | 182,87 |
| Cu | 1.16 | 0,35 | 32.46 |
| Ca | 1,01 | 0,44 | 72,97 |
| S | 0,4 | 0,22 | 35,82 |
| Mg | 0,14 | 0,1 | 9,07 |
| Mn | 0,1 | 0,03 | 4.05 |
Bảng 2. Nồng độ của các nguyên tố kim loại, PAH và các ion tan trong nước trong các mẫu thu được.
| Các phần tử kim loại (ng / m 3 ) | PAHs (ng / m 3 ) | PAHs (ng / m 3 ) | Các ion hòa tan trong nước (ng / m 3 ) |
| K 2638,91 | Naphtalen 0,13 | Benzo (k) flo 0,45 | NH 4 + 9,68 ± 1,31 |
| Fe 2432,14 | Axetilen 3,46 | Benzo (a) pyren 0,23 | Cl – 3,85 ± 1,79 |
| Na 2314.32 | Acenaphthene 0,83 | Dibenzo (a, h) anthracen 0,67 | SO 4 2− 20,47 ± 8,26 |
| Ca 2201.82 | Flo 0,26 | Benzo (g, h, i) perylene 0,26 | KHÔNG 3 – 12,69 ± 5,81 |
| Al 1458,24 | Phenanthrene 0,11 | Indeno 0,54 | |
| Mg 1288,89 | Anthracen ND | ||
| Zn 1262,97 | Flo 0,16 | ||
| Pb 365.43 | Pyrene 0,22 | ||
| Có TK 322,43 | Chrysene 0,32 | ||
| Mn 291.35 | Benzo (a) anthracen 0,49 | ||
| Cu 199,26 | Benzo (b) flo 0,51 |
Lưu ý: ND, không phát hiện; Các nguyên tố kim loại khác (không được liệt kê trong bảng, nồng độ trung bình <80 ng / m3 ) bao gồm Ni, V, As, Se, Ba, Sr, Rb, Mo, Cd, Sb, Ce, Co, Cs và La, cũng phát hiện trong các mẫu.
3.2. Ảnh hưởng của PM2.5 và Sulforaphane đến khả năng tồn tại của tế bào HBE
Thử nghiệm CCK-8 được thực hiện để xác định độc tính của PM2.5. Như được chỉ ra trong Hình 3 A-C, sự suy giảm khả năng sống của tế bào phụ thuộc vào thời gian và liều lượng đã được quan sát thấy ở các nhóm được điều trị bằng PM2.5. Đáng chú ý, so với nhóm đối chứng, ủ với 300 μg / mL PM2.5 trong 48 giờ làm giảm khả năng sống của tế bào xuống 63,54 ± 3,76% ( p <0,01). Đồng thời, điều trị bằng Sulforaphane dưới 8 μM không cho thấy bất kỳ ảnh hưởng đáng kể đến khả năng sống sót của tế bào HBE (p > 0,05) (Hình 3 D-F). Các thí nghiệm này được thực hiện để xác định nồng độ và thời gian ủ tối ưuPM2.5 và Sulforaphane cho các thí nghiệm tiếp theo. Do đó, dựa trên những kết quả này, tiền xử lý với Sulforaphane dưới 8 μM và ủ với 300 μg / mL PM2.5 đã được sử dụng trong các đánh giá tiếp theo.
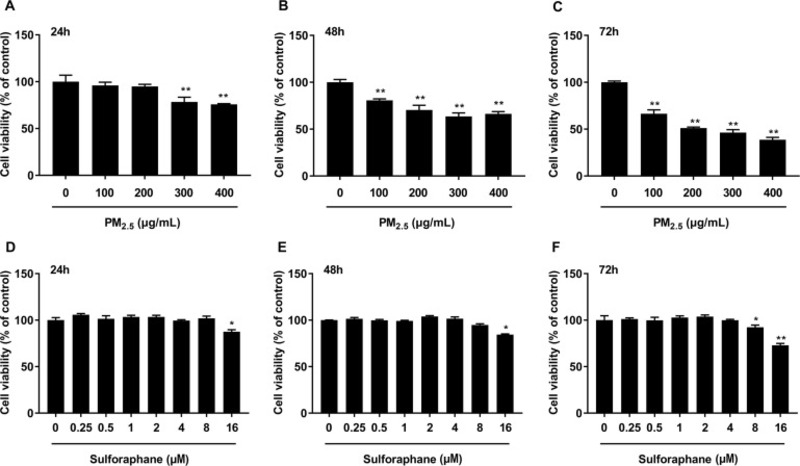
Hình 3. Ảnh hưởng của PM2.5 và sulforaphane đến khả năng sống sót của tế bào HBE. Tế bào HBE được ủ với PM2.5 (100–400 μg / mL) (A, B, C) và sulforaphane (0,25–16 μM) (D, E, F) trong 24, 48 và 72 giờ. Khả năng sống của tế bào được đánh giá bằng xét nghiệm CCK-8 sau khi ủ. Dữ liệu được trình bày dưới dạng phương tiện ± SD dựa trên ba thí nghiệm độc lập (n = 3). * p <0,05 và ** p <0,01, so với nhóm chứng.
3.3. Sulforaphane làm giảm bớt căng thẳng oxy hóa do PM2.5 gây ra
Trong phần này, một số dấu ấn sinh học liên quan đến stress oxy hóa đã được xác định, bao gồm khả năng tồn tại của tế bào, sự giải phóng LDH , hàm lượng MDA và mức độ ROS. Như thể hiện trong Hình 4A, ở các nhóm được điều trị trước bằng Sulforaphane, so với các nhóm được điều trị chỉ với PM2.5, khả năng sống của tế bào tăng lên đều đặn (1 μM SFN, 68,76 ± 2,90%, p <0,05; 2 μM SFN, 74,13 ± 1,54%, p <0,01; 4 μM SFN, 79,56 ± 2,46%, p <0,01). Đáng chú ý, so với nhóm đối chứng tích cực, khả năng sống sót tế bào của các tế bào được điều trị bằng 4 μM Sulforaphane đã tăng lên 79,56 ± 2,46%. Trong khi đó, không có sự khác biệt rõ ràng giữa nhóm được xử lý 5 μM SFN và nhóm đối chứng, cho thấy rằng tiền xử lý bằng Sulforaphane không ảnh hưởng đến khả năng sống sót của tế bào HBE (p > 0,05). Hàm lượng LDH trong phần nổi được thu thập từ các tế bào từ các nhóm xử lý khác nhau được thể hiện trong Hình 4 B. Kết quả chỉ ra rằng, so với các tế bào của nhóm đối chứng dương tính (185,24 ± 5,37%, p <0,01), lactate dehydrogenase trong phần nổi của các tế bào được điều trị bằng Sulforaphane giảm theo cách phụ thuộc vào liều lượng (1 μM SFN, 163,21 ± 7,50%, p <0,05; 2 μM SFN, 144,45 ± 9,38%,p <0,01; 4 μM SFN, 138,64 ± 13,79%, p <0,01).
Kết quả xét nghiệm MDA phù hợp với kết quả giải phóng LDH, cho thấy sự giảm đáng kể ở nhóm được điều trị bằng Sulforaphane 4 μM (129,26 ± 3,29%, p <0,01) như trong Hình 4 C. Nó chứng minh rằng mức ROS dương tính có kết quả tăng rõ rệt lên đến 309,93 ± 9,68% (p <0,01), so với nhóm chứng âm tính ( Hình 4 D). Tuy nhiên, trong các tế bào của nhóm được xử lý trước SFN, mức ROS thấp hơn đáng kể so với nhóm đối chứng dương tính (1 μM SFN, 233,34 ± 7,18%, p <0,05; 2 μM SFN, 187,83 ± 11,82%, p <0,01; 4 μM SFN, 161,64 ± 10,79%, p <0,01).
Bên cạnh việc định lượng ROS trong tế bào, kết quả hình ảnh từ kính hiển vi huỳnh quang xác nhận rằng tiền xử lý bằng Sulforaphane sẽ gây ra sự giảm phụ thuộc vào liều lượng của ROS trong tế bào HBE (Hình 5). Như được thể hiện trong Hình 5 D-E, việc xử lý trước 2 và 4 μM SFN đã làm giảm đáng kể cường độ huỳnh quang đến mức có thể so sánh với các tế bào bình thường không được xử lý. Đáng chú ý, so với các tế bào nhóm chứng âm tính, điều trị với 5 μM SFN không gây ra những thay đổi đáng kể về hàm lượng MDA hoặc mức ROS của tế bào HBE (p > 0,05). Dựa trên những kết quả ban đầu này, điều trị bằng Sulforaphane có cho thấy hiệu quả trong việc làm giảm căng thẳng oxy hóa do PM2.5 gây ra trong tế bào HBE.
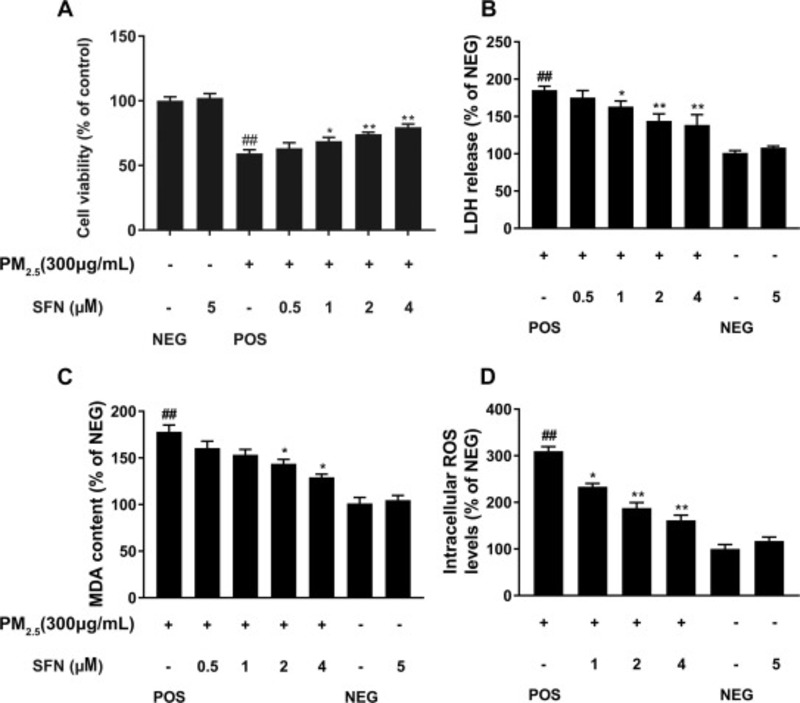
Hình 4. Tiền xử lý SFN làm giảm các thiệt hại oxy hóa do PM2.5 gây ra, bao gồm khả năng tồn tại của tế bào (A), sự giải phóng LDH (B), hàm lượng MDA (C) và mức ROS nội bào (D). Dữ liệu được trình bày dưới dạng phương tiện ± SD dựa trên ba thí nghiệm độc lập (n = 3). * p <0,05 và ** p <0,01, so với nhóm chứng.
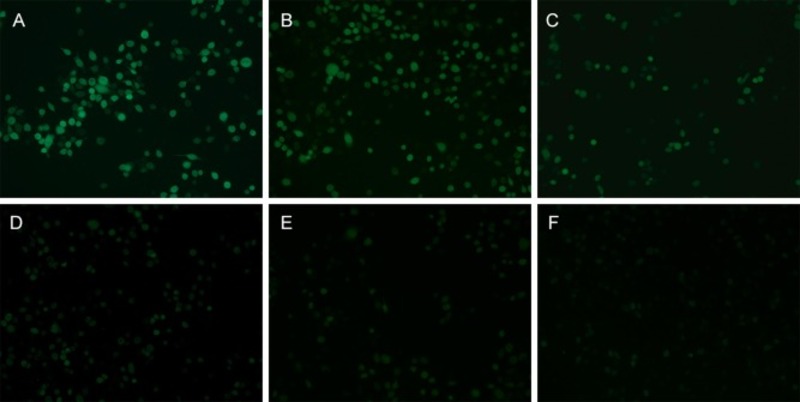
Hình 5. Tiền xử lý SFN làm giảm bớt sự tích tụ ROS do PM2.5 gây ra trong tế bào HBE. Phát hiện huỳnh quang mức ROS trong các tế bào được xử lý bằng PM2.5 hoặc PM2.5 cùng với các nồng độ sulforaphane khác nhau. (A) nhóm đối chứng dương tính, các tế bào được điều trị chỉ với PM2.5. (B) SFN 1 + PM2.5 (300 μg / mL). (C) SFN 2 + PM2.5 (300 μg / mL). (D) SFN 4 + PM2.5 (300 μg / mL). (E) nhóm đối chứng âm tính, các tế bào được xử lý không có SFN hoặc PM2.5. (F) Nhóm kiểm soát SFN, các tế bào được xử lý bằng 5 μM SFN.
3.4 . Ảnh hưởng của Sulforaphane đối với quá trình chết rụng tế bào do PM2.5 gây ra
Theo kết quả từ nhuộm Annexin V-FITC và PI (Hình 6 C), tỷ lệ các thể chết bao gồm tế bào chết sớm và tế bào chết muộn ở các tế bào được xử lý PM2.5 cao hơn. Như được mô tả trong Hình 6 C, so với các tế bào của nhóm đối chứng âm tính, tiếp xúc với PM2.5 làm tăng đáng kể tỷ lệ tế bào chết theo chương trình (21,24 ± 2,82%, p <0,01). Tuy nhiên, việc ủ trước với Sulforaphane 2 và 4 μM đã làm giảm đáng kể quá trình chết rụng tế bào ở các tế bào HBE, làm giảm tỷ lệ chết rụng xuống lần lượt là 15,64 ± 2,42% (p <0,05) và 13,17 ± 1,90% (p <0,01).
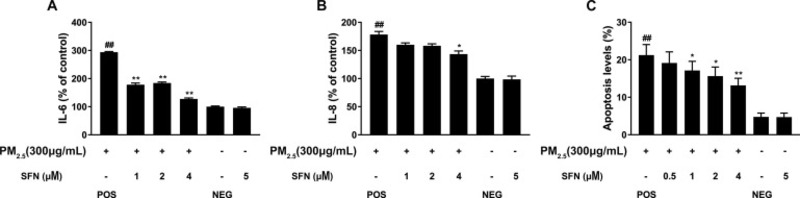
Hình 6. SFN trước khi điều trị làm giảm phản ứng viêm do PM2.5 gây ra và quá trình apoptosis. (A) Tiền xử lý bằng sulforaphane làm giảm mức IL-6 trong các tế bào tiếp xúc với PM2.5. (B) Tiền xử lý bằng sulforaphane làm giảm mức IL-8 trong các tế bào tiếp xúc với PM2.5. (C) Tiền xử lý bằng sulforaphane làm giảm tỷ lệ tự chết của tế bào. Dữ liệu được trình bày dưới dạng phương tiện ± SD dựa trên ba thí nghiệm độc lập (n = 3). * p <0,05 và ** p <0,01, so với nhóm chứng. ## p <0,01, so với nhóm chứng âm tính.
3.5. Sulforaphane làm giảm bớt tình trạng viêm do PM2.5 gây ra
Như được thể hiện trong Hình 6 A-B, so với các tế bào của nhóm đối chứng âm tính, việc tiếp xúc với PM2.5 làm tăng đáng kể việc tiết IL-6 (293,91 ± 2,35%, p <0,01) và IL-8 (178,32 ± 5,52%, p <0,01) từ các tế bào HBE. Tiền xử lý bằng Sulforaphane gây ra sự giảm tiết IL-6 trong tế bào HBE (1 μM SFN, 178,2 ± 5,9%, p <0,01; 2 μM SFN, 184,15 ± 3,79%, p <0,01; 4 μM SFN, 127,59 ± 3,48%, p <0,01). Mặc dù 1 và 2 μM sulforaphane không ức chế đáng kể sự bài tiết IL-8 ở phần nổi của môi trường nuôi cấy tế bào ( p > 0,05), 4 μM sulforaphane vẫn làm giảm đáng kể nồng độ IL-8 trong phần nổi của môi trường nuôi cấy (p <0,05).
3.6. Sulforaphane làm giảm các tổn thương do oxy hóa thông qua việc kích hoạt con đường chống oxy hóa Nrf2 / Keap1
Như được thể hiện trong Hình 7, so với các tế bào của nhóm đối chứng âm tính, việc tiếp xúc với PM2.5 làm giảm đáng kể mức độ hạt nhân Nrf2 và gen đích HO-1 của nó trong các tế bào HBE trong khi điều trị bằng Sulforaphane một mình làm tăng mức độ hạt nhân của Nrf2 và tế bào chất mức HO-1. Đồng thời, ủ trước bằng Sulforaphane đã làm tăng đáng kể mức độ hạt nhân Nrf2 và HO-1 trong các tế bào nhóm được xử lý PM2.5. Hơn nữa, ủ trước với 4 μM Sulforaphane có thể tạo ra mức hạt nhân Nrf2 và HO-1 cao hơn so với các tế bào nhóm PM2.5 được xử lý trước bằng 1 μM Sulforaphane.
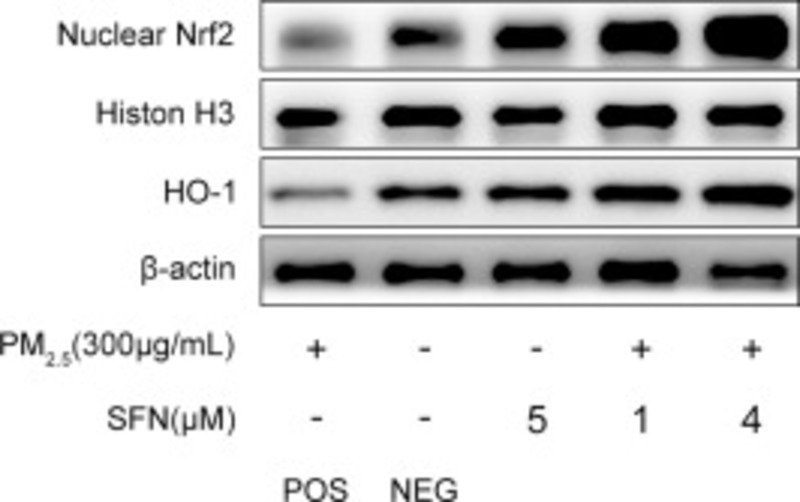
Hình 7. SFN bảo vệ các tế bào HBE chống lại các tổn thương oxy hóa do PM2.5 gây ra thông qua việc kích hoạt con đường chống oxy hóa Nrf2 / Keap1. Mức độ biểu hiện của hạt nhân Nrf2 và HO-1 đã được phát hiện bởi Western blot. Mật độ của protein hạt nhân tương đối với Histon H3. Mật độ của tổng số protein tương đối với β-actin.
4. Thảo luận thêm về công dụng của Sulforaphane trong việc giảm độc tố của PM2.5

Trong nghiên cứu này, đặc tính của các mẫu thu thập được đã được mô tả, chú trọng vào các thành phần hóa học của chúng. Cùng với các nghiên cứu trước đây, ảnh SEM và kết quả EDX cho thấy các hạt thu thập được có đường kính trung bình <500 nm dường như là hình dạng vô định hình. Hơn nữa, chúng tôi quan sát thấy rằng các hạt có xu hướng dính vào các sợi và kết tụ chặt chẽ để tạo thành các khoáng chất kéo dài có nhiều trong các nguyên tố kim loại (Shi và cộng sự, 2015, Zou và cộng sự, 2017). Các cuộc điều tra hình thái học này cùng với các nghiên cứu trước đây cho thấy PM2.5 có thể hấp thụ các hóa chất độc hại và hoạt động như một phương tiện chuyển các chất độc hại này trong quá trình xâm nhập và lắng đọng ở phổi hoặc các cơ quan ngoài phổi (Bełcik và cộng sự, 2018, Li và cộng sự, 2019). Trong khi đó, kích thước nhỏ và diện tích bề mặt lớn cho phép PM2.5 hấp thụ nhiều thành phần có hại hơn như kim loại nặng, ion hòa tan trong nước và PAH, nguyên nhân dẫn đến việc tạo ra ROS sớm và gây viêm (Zou, Jin, Su, Li, & Zhu, 2016). Đồng thời, cần lưu ý rằng thành phần hóa học và hình thái của PM2.5 có thể bị ảnh hưởng bởi nhiều yếu tố như thời gian, thời tiết, nguồn và địa điểm thu thập (Dong et al., 2019).
Mặc dù các thành phần phức tạp của PM2.5 và các con đường cơ học đa dạng khiến việc điều tra chính xác các cơ chế cơ bản của độc tính do PM2.5 gây ra rất khó khăn, nhiều nghiên cứu đã chỉ ra rằng stress oxy hóa, phản ứng viêm, rối loạn chuyển hóa và độc tính gen đóng vai trò quan trọng trong sự nguy hiểm của PM2.5 (Feng, Gao, Liao, Zhou, & Wang, 2016). Trong số các cơ chế cơ bản này, căng thẳng oxy hóa và viêm được coi là thủ phạm của các bệnh cấp tính và mãn tính liên quan đến PM2.5 như hen suyễn, bệnh phổi tắc nghẽn mãn tính (COPD), huyết khối, xơ vữa động mạch, hệ thần kinh tự chủ (ANS), lão hóa da và bệnh đái tháo đường týp II (Liu và cộng sự, 2019, Mohammed và cộng sự, 2016, Nel và cộng sự, 2001, Xu và cộng sự, 2019 ). Do đó, căng thẳng oxy hóa và viêm nhiễm luôn là điểm nóng và các nhà khoa học đã tìm kiếm các hợp chất hoạt tính sinh học nhắm vào ROS và các phản ứng viêm bên cạnh quá trình lọc vật lý và điều trị bằng thuốc.
Như đã biết, các loại oxy phản ứng dùng để chỉ các gốc phản ứng hóa học có chứa oxy mà chủ yếu bao gồm peroxit, superoxide, gốc hydroxyl và oxy đơn. Trong trường hợp bình thường, việc sản xuất và loại bỏ các loại oxy phản ứng trong tế bào chất được cân bằng tốt bởi các enzym nội sinh như superoxide dismutase (SOD) và catalase (CAT) và các chất chống oxy hóa không phải enzym khác như chu trình oxy hóa khử glutathione và vitamin (Tong, Chuang, Wu & Zuo, 2015 ). Ngoài ra, lượng oxy phản ứng vừa phải là cần thiết và có lợi để duy trì trạng thái cân bằng nội môi của tế bào thông qua một số con đường sinh học (Bhattacharyya, Chattopadhyay, Mitra và Crowe, 2014). Tuy nhiên, sự cân bằng này dễ bị thay đổi do các yếu tố căng thẳng ngoại sinh như chất ô nhiễm, bức xạ, khói thuốc lá và một số loại thuốc (Nicco & Batteux, 2018). Đối với PM2.5, trong quá trình xâm nhập qua khí quản phổi và lắng đọng vào vùng phế nang, các loại oxy phản ứng dư thừa được tạo ra do các loại oxy phản ứng của chính nó và các chất oxy hóa ủng hộ khác có trong PM2.5 như kim loại chuyển tiếp và PAH (Poyton, Castello, Ball, Woo, & Pan, 2009). Hơn nữa, việc tạo ra dư thừa các loại oxy phản ứng cũng hoạt động như các phân tử tín hiệu để gây ra sự bài tiết các cytokine gây viêm thông qua nhiều thụ thể trên màng và các đường dẫn truyền tín hiệu xuôi dòng tương quan, dẫn đến các phản ứng viêm ở vùng phổi. Tệ hơn nữa, những phản ứng viêm tại chỗ này sẽ được khuếch đại qua hệ thống tuần hoàn đến các mô và cơ quan khác, dần dần dẫn đến viêm toàn thân.
Trong nghiên cứu này, chúng tôi quan sát thấy PM2.5 làm giảm khả năng sống của tế bào theo cách phụ thuộc vào thời gian và liều lượng. So với các tế bào của nhóm đối chứng âm tính, ủ với 300 μg / mL PM2.5 trong 48 giờ làm giảm khả năng sống của tế bào xuống 63,54 ± 3,76% (p <0,01). Tương ứng, mức ROS của các tế bào kiểm soát tích cực gấp khoảng 3 lần so với các tế bào thuộc nhóm kiểm soát âm tính. Đồng thời, LDH, một chất chỉ thị trực tiếp về tính toàn vẹn của màng tế bào, cũng tăng lên trong phần nổi của tế bào được kích thích bởi chiết xuất PM2.5 khoảng 1,8 lần so với tế bào đối chứng âm tính. Hơn nữa, việc ủ với chiết xuất PM2.5 đã nâng cao mức MDA (sản phẩm cuối cùng của quá trình oxy hóa lipid) của các tế bào kiểm soát tích cực. Cuối cùng, so với các tế bào của nhóm đối chứng âm tính, tỷ lệ apoptosis của tế bào của nhóm đối chứng dương tính đã tăng lên khoảng 16,5%. Dựa trên những kết quả này, chúng tôi đã chứng minh rằng kích thích PM2.5 sẽ dẫn đến sự tích tụ ROS trong tế bào chất, dẫn đến stress oxy hóa trong tế bào. Hơn nữa, việc tạo ra ROS dư thừa sẽ phản ứng với protein, lipid, cũng như DNA của tế bào HBE, làm suy giảm tính toàn vẹn của màng tế bào và dẫn đến tăng hàm lượng MDA. Quá trình ủ kéo dài với các mẫu PM dẫn đến tác động liên tục của stress oxy hóa, làm giảm dần khả năng sống của tế bào và thậm chí dẫn đến quá trình chết rụng của tế bào. Phát hiện này phù hợp với in vitro trước đó và các nghiên cứu in vivo tập trung vào độc tính của PM2.5. Ví dụ, Zou et al. (2016) cho tế bào A549 (tế bào biểu mô đáy phế nang của người) tiếp xúc với các thành phần hòa tan trong nước và không hòa tan trong nước của PM2.5. Kết quả chứng minh rằng các thành phần hòa tan trong nước có thể làm giảm khả năng sống của tế bào, thay đổi hình thái và tạo ra ROS dư thừa thông qua stress oxy hóa. Trong khi, các thành phần không tan trong nước có liên quan đến sự phá vỡ màng tế bào. Zhang và cộng sự. (2018) đã sử dụng cá ngựa vằn làm mô hình in vivo để điều tra độc tính của PM2.5. Họ phát hiện ra rằng điều trị PM2.5 làm giảm đáng kể hệ thống phòng thủ chống oxy hóa và tạo ra ROS ở ấu trùng cá ngựa vằn.
Để hiểu cơ chế chi tiết của stress oxy hóa và tác động của rối loạn chức năng màng tế bào, nghiên cứu này đã tiến lên một bước mới để tìm ra nguồn gốc của ROS và các phản ứng sinh học tương quan. Việc tạo ra ROS dư thừa có thể được chia thành các nguồn ngoại sinh và nguồn nội sinh. Các nguồn ngoại sinh chủ yếu đến từ quá trình thực bào của các tế bào miễn dịch, các phản ứng giữa các PAH, cũng như ROS có trong các hạt PM2.5. Ngoài chất lỏng niêm mạc đường hô hấp (RTLF), các tế bào biểu mô và tế bào miễn dịch đại diện cho tuyến phòng thủ đầu tiên của hệ thống miễn dịch của chúng ta để phản ứng với sự phơi nhiễm PM2.5. Các tế bào miễn dịch của họ như đại thực bào và bạch cầu ái toan sẽ loại bỏ các hạt PM2.5 và vi khuẩn xâm nhập thông qua quá trình thực bào và bùng phát oxy hóa, nơi một lượng lớn ROS như anion superoxide và hydrogen peroxide có thể được sản xuất và giải phóng bởi NADPH oxidase (NOX2). Zhang, Yang, Li, Geng, and Dong (2015) cho đại thực bào phế nang tiếp xúc với phấn PM2.5 và sử dụng hóa phát quang phát hiện để phân tích ROS phát ra từ các tế bào. Kết quả chỉ ra rằng ROS phát ra từ đại thực bào tăng lên phụ thuộc vào liều lượng. Mức độ ROS phát ra của các đại thực bào được xử lý với 500 μg / mL PM2.5 phấn cao hơn khoảng 16 lần so với các tế bào được ủ với 50 μg / mL PM2.5. Ngoài ra, sự rò rỉ LDH và giảm khả năng sống của tế bào cũng được quan sát thấy. Mặt khác, ty thể, lưới nội chất, peroxisome, xanthine oxidase và NADPH oxidase là những thành phần chính của ROS nội sinh. Ti thể và lưới nội chất là những bào quan chính chịu trách nhiệm tạo ra năng lượng và biến đổi protein, trong đó có thể tạo ra một lượng lớn ROS. Wang, Wu và Tang (2020) đã chứng minh rằng tiếp xúc với PM xung quanh có thể gây ra những thay đổi hình thái và rối loạn chức năng của ty thể và lưới nội chất thông qua stress oxy hóa và dòng canxi trong tế bào nội mô của con người, sau đó dẫn đến quá trình chết của tế bào. Thật thú vị, chúng tôi nhận thấy rằng các mẫu PM của chúng tôi chứa nhiều nguyên tố canxi, chiếm khoảng gần 15% tổng số nguyên tố kim loại. Hơn nữa, các kim loại chuyển tiếp như Fe, Cu và Zn cũng có nhiều trong các mẫu thu thập. Do stress oxy hóa làm hỏng đáng kể tính toàn vẹn của màng tế bào, chúng tôi giả thuyết rằng sự suy yếu của màng tế bào sẽ dẫn đến dòng chảy của các kim loại chuyển tiếp và canxi và dần dần gây ra sự mất cân bằng nội môi canxi và tạo ROS từ ty thể và lưới nội chất. Sự rối loạn chức năng và thay đổi hình thái của các bào quan này, kết hợp với ROS nội sinh, sẽ làm trầm trọng thêm tình trạng stress oxy hóa trong tế bào và cuối cùng đẩy nhanh quá trình apoptosis. Tuy nhiên, nhiều cuộc điều tra hơn nên được đảm bảo để xác minh giả thuyết, bao gồm xác nhận dòng kim loại trong tế bào và những thay đổi về chức năng và hình thái của các bào quan trước và sau khi tiếp xúc với PM2.5.
Viêm là một yếu tố chi phối khác gây ra độc tính do PM2.5 gây ra, đặc biệt là đối với các bệnh mãn tính do tiếp xúc với PM2.5. Các hạt PM2.5, các cytokine gây viêm như yếu tố hoại tử khối u alpha (TNF-α), IL-6 và IL-8, PAHs, cũng như ROS hoạt động như tín hiệu để kích hoạt các thụ thể khác nhau trên màng như các thụ thể Toll-like (TLR) và các thụ thể hydrocacbon aryl (AhRs) và các con đường tín hiệu xuôi dòng như yếu tố hạt nhân kappa-chất tăng cường chuỗi ánh sáng của các tế bào B hoạt hóa (NF-κB) con đường truyền tín hiệu, cuối cùng dẫn đến sự biểu hiện của các cytokine và chất trung gian gây viêm. Kích hoạt kéo dài các phản ứng viêm không chỉ gây ra suy giảm cục bộ cho hệ thống phổi mà còn gây viêm toàn thân ở các mô và cơ quan khác, làm tăng nguy cơ mắc các bệnh mãn tính (Peter và cộng sự, 2015). Fernando và cộng sự (2019) cho tế bào A549 tiếp xúc với các hạt PM2.5 và chứng minh rằng PM2.5 gây ra sự gia tăng rõ rệt trong các biểu hiện của chất trung gian gây viêm như prostaglandin-endoperoxide synthase 2 (COX-2) và Prostaglandin E2(PGE2), cũng như các cytokine gây viêm như TNF-α và IL-6. Nhất quán với nghiên cứu này, chúng tôi quan sát thấy rằng việc điều trị bằng các hạt PM2.5 làm tăng đáng kể các biểu hiện của IL-6 và IL-8 trong các tế bào ở các nhóm đối chứng tích cực.
Tuy nhiên, việc xử lý trước bằng Sulforaphane đã làm tăng đáng kể khả năng sống của tế bào và làm giảm bớt sự giải phóng LDH và hàm lượng MDA đến mức có thể so sánh với các tế bào của nhóm đối chứng âm tính. Đồng thời, Sulforaphane cũng cải thiện các chỉ số về tổn thương oxy hóa và phản ứng viêm, đặc trưng bởi sự giảm mức ROS, giảm tỷ lệ tế bào apoptotic và giảm sự biểu hiện của IL-6 và IL-8. Sulforaphane từ lâu đã được coi là một chất hóa học thực vật mạnh vì khả năng chống oxy hóa, chống viêm và chống ung thư. Việc kích hoạt lộ trình truyền tín hiệu Nrf2-Keap1 (Kelch-like ECH-linked protein 1) đóng một vai trò quan trọng trong các phản ứng chống oxy hóa và chống viêm của Sulforaphane và là nền tảng cho sự thích nghi và tồn tại của tế bào trong các điều kiện căng thẳng khác nhau. Cụ thể, Sulforaphane có thể sửa đổi các cysteine cảm biến của Keap1 và làm suy giảm liên kết giữa Nrf2 và Keap1. Do đó, sự tích tụ của Nrf2 dẫn đến sự chuyển vị của Nrf2 vào nhân nơi nó liên kết với vùng ARE để điều chỉnh các biểu hiện của nhiều enzym và protein bảo vệ tế bào như glutathione S-transferase (GST), NAD (P) H: quinone oxidoreductase l (NQO-1), heme oxygenase-1 (HO-1) và đẩy nhanh quá trình tổng hợp và tái tạo glutathione (Tebay, Robertson, Durant, Vitale, Penning, Dinkova-Kostova, & Hayes, 2015). Hơn nữa, việc kích hoạt Nrf2 cũng có thể gián tiếp làm dịu chứng viêm thông qua việc ức chế NF-κB và AP-1 (Dinkova-Kostova et al., 2017). Cuối cùng, Sulforaphane có tác dụng chống viêm mạnh thông qua con đường tín hiệu protein kinase (MAPK) được kích hoạt bởi mitogen như ức chế sự phosphoryl hóa p38 và JNK (Deramaudt, Ali, Vinit, & Bonay, 2020). Heber và cộng sự. (2014) tuyển chọn 29 đối tượng khỏe mạnh và thử thách họ bằng khí thải dieselsau khi sử dụng chiết xuất mầm bông cải xanh trong 4 ngày. Kết quả chỉ ra rằng việc sử dụng Sulforaphane làm giảm đáng kể tổng số bạch cầu trong dịch rửa mũi của những người khỏe mạnh. Sakurai và cộng sự. (2018) đã sử dụng những con chuột nhạy cảm với OVA và thử thách chúng với khói thuốc lá và Sulforaphane. Họ phát hiện ra rằng Sulforaphane khôi phục độ nhạy cảm với steroid của chuột bị hen thông qua việc điều chỉnh đường truyền tín hiệu Nrf2. Cùng với những phát hiện này, kết quả của phương pháp Western blot của chúng tôi với các thí nghiệm chỉ ra rằng điều trị bằng Sulforaphane sẽ làm tăng đáng kể mức độ hạt nhân Nrf2 và gen mục tiêu HO-1 của nó, cho thấy rằng tác dụng bảo vệ của Sulforaphane chống lại sự phơi nhiễm PM2.5 có thể là do sự kích hoạt con đường tín hiệu Nrf2 / Keap1.
5. Kết luận
Kết luận, đặc điểm của các hạt PM2.5 chứng minh rằng các mẫu thu thập được là các hạt mịn có đường kính trung bình <500 nm và có nhiều kim loại chuyển tiếp như Cu và Fe và PAHs như acenaphthylene và acenaphthene, góp phần gây ra các tổn thương oxy hóa và phản ứng viêm.
Ngoài ra, nghiên cứu này cũng cho thấy PM2.5 gây ra căng thẳng oxy hóa và phản ứng viêm trong tế bào HBE, cuối cùng dẫn đến sự ức chế sự phát triển của tế bào và thậm chí là quá trình chết tế bào. Mặc dù Sulforaphane từ lâu đã được coi là chất cảm ứng Nrf2 mạnh với các đặc tính chống oxy hóa, chống viêm và chống ung thư, nhưng vẫn chưa rõ liệu nó có thể phát huy tác dụng bảo vệ chống lại các tổn thương do PM2.5 gây ra ở các tế bào khỏe mạnh có nguồn gốc từ con người hay không. Trong nghiên cứu này, chúng tôi đã chứng minh rằng việc bổ sung Sulforaphane làm giảm đáng kể các tổn thương do PM2.5 gây ra đối với các tế bào HBE có nguồn gốc từ các cá thể không ung thư, bao gồm sự tích tụ ROS, ức chế tăng trưởng tế bào, suy giảm tính toàn vẹn của màng tế bào, sự giảm khả năng tồn tại của tế bào, tỷ lệ apoptosis của tế bào, cũng như việc giải phóng các cytokine gây viêm.
Mặc dù vẫn cần nhiều nghiên cứu hơn trong tương lai, chúng tôi giả thuyết rằng cơ chế điều hòa lộ trình truyền tín hiệu Nrf2-ARE và NF-κB có thể là cơ chế phân tử cơ bản chịu trách nhiệm về tác dụng bảo vệ của Sulforaphane chống lại căng thẳng oxy hóa và viêm dựa trên phát hiện ở bài nghiên cứu này và các nghiên cứu trước đây. Đáng chú ý, ngoài hoạt tính sinh học mạnh, Sulforaphane cũng có sinh khả dụng cao ở người vì > 70% Sulforaphane có thể được hấp thu, chuyển hóa và chuyển hóa thành dithiocarbamat (Fahey, Wehage, Holtzclaw, Kensler, Egner, Shapiro, & Talalay, 2012). Do đó, dựa trên hoạt tính sinh học, khả dụng sinh học, nguồn gốc và giá cả, Sulforaphane có thể là một lựa chọn thay thế để làm giảm các tác động tiêu cực đến sức khỏe do PM2.5 gây ra.
Kết hợp với nhau, nghiên cứu này cung cấp cơ sở lý thuyết về Sulforaphane như một hợp chất hoạt tính sinh học có nguồn gốc thực phẩm đầy hứa hẹn chống lại các tổn thương do PM2.5 gây ra trong các thử nghiệm lâm sàng và xác nhận in vivo tiếp theo, làm sáng tỏ sự phát triển của các chất ngăn ngừa ô nhiễm không khí có nguồn gốc từ thực phẩm. Bên cạnh việc kiểm soát chính sách và điều trị y tế, các can thiệp dinh dưỡng như bổ sung đầy đủ các hợp chất hoạt tính sinh học có nguồn gốc từ thực phẩm có thể là một cách khả thi và hiệu quả để giảm các tác động tiêu cực đến sức khỏe liên quan đến các chất dạng hạt mịn trong tương lai.
4. Các chủ đề liên quan
Dưới đây là một số bài viết về các chủ đề nghiên cứu có liên quan đến hoạt chất Sulforaphane và công dụng của chúng:
- Mầm bông cải xanh giàu chất cảm ứng của các enzyme bảo vệ giúp chống lại ung thư
- Tác dụng bảo vệ của chiết xuất bông cải xanh và Sulforaphane chống lại sự căng thẳng oxy hóa
- Sulforaphane : Một sản phẩm tự nhiên chống lại các loại oxy phản ứng
5. Tham vấn chuyên môn
- Bác sĩ
- Nguồn tham khảo: https://www.sciencedirect.com/science/article/pii/S1756464621001092

