- Tổng quan
- 1. Nguyên liệu và phương pháp
- 1.1. Thu thập và tiền xử lý PM2.5
- 1.2. Nuôi cấy tế bào
- 1.3. Đặc tính của PM2.5
- 1.4. Khả năng di động
- 1.5. Giải phóng lactate dehydrogenase (LDH)
- 1.6. Hàm lượng malondialdehyde (MDA)
- 1.7. Các loại oxy phản ứng (ROS)
- 1.8. Quá trình chết của tế bào
- 1.9. Các cytokine gây viêm
- 1.10. Phong cách phương Tây
- 1.11. Phân tích thống kê
- 2. Các kết quả
- 2.1. Đặc điểm và thành phần hóa học của PM2.5
- 2.2. Ảnh hưởng của PM2.5 và Sulforaphane đến khả năng tồn tại của tế bào HBE
- 2.3. Sulforaphane làm giảm bớt căng thẳng oxy hóa do PM2.5 gây ra
- 2.4. Ảnh hưởng của sulforaphane đối với quá trình chết rụng tế bào do PM2.5 gây ra
- 2.5. Sulforaphane làm giảm bớt tình trạng viêm do PM2.5 gây ra
- 2.6. Sulforaphane làm giảm các tổn thương do oxy hóa thông qua việc kích hoạt con đường chống oxy hóa Nrf2 / Keap1
- Kết luận
Giảm căng thẳng oxy hóa và tình trạng viêm nhờ Sulforaphane có thật hay không? Nghiên cứu được tiến hành như thế nào? Kết quả của nghiên cứu kết luận ra sao?
Tổng quan

PM2.5 có thể gây hại trực tiếp đến lá phổi và ảnh hưởng đến sức khỏe tổng thể của con người trên toàn thế giới. Tình trạng căng thẳng và viêm nhiễm do oxy hóa là hai yếu tố quyết định làm nên độc tính của PM2.5.
Sulforaphane, một chất phytochemical chủ yếu có nguồn gốc từ các loại rau họ cải được cho là có hiệu quả làm giảm căng thẳng oxy hóa và chống viêm. Chính vì thế, nghiên cứu này đánh giá và làm rõ tác dụng bảo vệ của Sulforaphane trong việc chống lại các tổn thương do PM2.5 gây ra trong các tế bào biểu mô phế quản (HBE) ở người. Cùng với đó là điều tra các đặc tính sinh lý của PM2.5.
Kết quả cho thấy PM2.5 chủ yếu là các hạt mịn có nhiều trong các kim loại chuyển tiếp và PAH, một phần nguyên nhân dẫn đến việc tạo ra dư thừa các loại oxy phản ứng (ROS). Hơn nữa, tiếp xúc với PM2.5 dẫn đến tổn thương oxy hóa và phản ứng viêm trong tế bào. Tuy nhiên, tiền xử lý với Sulforaphane đã làm giảm đáng kể những tác động tiêu cực này, có thể là thông qua con đường liên quan đến yếu tố hạt nhân E2 yếu tố 2/yếu tố đáp ứng chống oxy hóa (Nrf2 / ARE). Nói chung, những phát hiện này đều chứng minh rằng việc tiền xử lý bằng Sulforaphane sẽ cải thiện tổn thương tế bào do PM2.5 gây ra thông qua việc ức chế căng thẳng oxy hóa và viêm trong tế bào HBE.
1. Nguyên liệu và phương pháp
1.1. Thu thập và tiền xử lý PM2.5
Các mẫu không khí được các nhà nghiên cứu thu thập dựa trên bộ lọc sợi thủy tinh (GE Healthcare Inc., Chicago, IL, Hoa Kỳ) từ tháng 6 năm 2017 đến tháng 12 năm 2018 với bộ thu TH-1000H PM2.5 (Wuhan Tianhong Instruments Co., Ltd., Vũ Hán, Trung Quốc) vận hành ở 1,05 m3/phút và máy lấy mẫu khối lượng thấp do Airmetrics (AirMetrics Inc., Eugene, OR, USA) sản xuất hoạt động ở 5L/phút cho 24 ha ngày.
Thiết bị thu gom được đặt trên nóc tòa nhà Phòng thí nghiệm trọng điểm của Nhà nước về Khoa học và Công nghệ Thực phẩm (Vô Tích, Trung Quốc) (vĩ độ 31 ° 28’N, kinh độ 120 ° 16’E), nơi không có nguồn ô nhiễm rõ ràng nào gần đó.
Sau khi thu thập xong, các bộ lọc các chất dạng hạt mịn được bảo quản ở nhiệt độ -20°C để nghiên cứu thêm. Bộ lọc được cắt thành 1×1 cm, 2 mảnh và tràn vào nước khử ion. Các huyền phù nước được ngâm trong 3×15 phút và đi qua gạc tám lớp. Cuối cùng, chúng sẽ được đông khô trong chân không.
Các hạt PM2.5 được cân và bổ sung với dung dịch muối đệm photphat (PBS, pH7,0, 0,01 M) để có được nồng độ cuối cùng là 20 mg/mL. Giải pháp ban đầu là chiếu tia cực tím để tránh nội độc tố. Trước khi thử nghiệm, dung dịch gốc PM2.5 đã được pha loãng với môi trường Eagle đã sửa đổi của Dulbecco có bổ sung 10% huyết thanh bò thai và được ngâm trong 20 phút để thu được dung dịch đồng nhất.
1.2. Nuôi cấy tế bào
Tế bào biểu mô phế quản của con người được lấy từ Cơ sở hạ tầng của Nguồn tế bào Trung Quốc (Bắc Kinh, Trung Quốc). Tế bào được nuôi cấy ở 37°C với 5% CO2 trong môi trường Eagle đã sửa đổi của Dulbecco (chứa phenol đỏ) (GE Healthcare Inc., Chicago, IL, USA) được bổ sung 10% huyết thanh bò thai (Gibco, Life Technologies Co., Grand Island, NY, USA) và 1% penicillin / streptomycin (Gibco, Life Technologies Co., Grand Island, NY, USA).
1.3. Đặc tính của PM2.5

Đặc điểm của PM2.5 bao gồm hình thái vi mô, đường kính trung bình, các nguyên tố kim loại, các ion hòa tan trong nước và các hydrocacbon thơm đa vòng (PAHs). Vì hình thái và thành phần hóa học của PM2.5 bị ảnh hưởng bởi nhiều yếu tố, một phần bộ lọc đại diện được thu thập vào mùa đông 2018 đã được sử dụng trong các nghiên cứu này.
Hình thái vi mô được khảo sát bằng kính hiển vi điện tử quét phát xạ trường lạnh (CFE-SEM) (của Công ty TNHH Hitachi, Tokyo, Nhật Bản). Sự tán xạ ánh sáng động (Malvern Panalytical Co. Ltd., Royston, Vương quốc Anh) đã được áp dụng để khảo sát sự phân bố kích thước của các mẫu PM thu thập được.
Kính hiển vi điện tử quét kết hợp với quang phổ tia X phân tán năng lượng (SEM-EDX) (Công ty TNHH Hitachi, Tokyo, Nhật Bản) được sử dụng để khảo sát các yếu tố của bề mặt mẫu. Để xác định nồng độ của các nguyên tố kim loại trong các mẫu PM, người ta đã thu được phép đo phổ phát xạ quang plasma kết hợp cảm ứng (ICP-OES) (PerkinElmer Inc., Waltham, MA, USA). Sắc ký ion(IC) (Dionex Inc., Sunnyvale, CA, USA) và sắc ký khí – khối phổ riêng biệt (GC – MS) (Shimadzu Inc., Kyoto, Nhật Bản) đã được áp dụng để khảo sát nồng độ của các ion hòa tan trong nước và nồng độ của các nguyên tố kim loại tương ứng. Tóm lại, quá trình tiền xử lý và xử lý các nguyên tố kim loại, các ion hòa tan trong nước và các hydrocacbon thơm đa vòng đều được thực hiện theo các tiêu chuẩn quốc gia của Trung Quốc (HJ 657-2013, HJ 799-2016 và HJ 646-2013).
1.4. Khả năng di động
Khả năng sống của tế bào được đo bằng CCK-8 (phòng thí nghiệm Dojindo, Kumamoto, Nhật Bản) theo hướng dẫn của nhà sản xuất. Tế bào được gieo hạt trong đĩa 96 giếng với mật độ 1.000 tế bào mỗi giếng. Sau khi ủ trong 24 giờ, các tế bào được rửa sạch và ủ với PM2.5 hoặc Sulforaphane (Sigma-Aldrich Co. Ltd., St. Louis, MO, USA) trong thời gian cụ thể. Sau đó, các tế bào sống được nhuộm bằng dung dịch CCK-8 10% và ủ trong 2 giờ. Độ hấp thụ được đo ở bước sóng 450nm bằng đầu đọc vi tấm (Bio-Rad Laboratories Inc., Hercules, CA, Hoa Kỳ) ở nhiệt độ phòng.
1.5. Giải phóng lactate dehydrogenase (LDH)
Sự giải phóng lactate dehydrogenase được xác định bằng một bộ công cụ thương mại (Viện Công nghệ Sinh học Beyotime, Thượng Hải, Trung Quốc). Tóm lại, sau khi xử lý bằng PM2.5, phần nổi phía trên của môi trường tế bào sẽ được thu thập và xét nghiệm theo hướng dẫn của nhà sản xuất.
1.6. Hàm lượng malondialdehyde (MDA)
Hàm lượng malondialdehyde được xác định bằng một bộ xét nghiệm thương mại (Viện Công nghệ Sinh học Beyotime, Thượng Hải, Trung Quốc). Tế bào được thu hoạch và tiếp tục nghiên cứu trong dung dịch đệm ly giải. Sau khi ly tâm ở 12.000g trong 10 phút, phần nổi của dịch bào được thu thập và xác định theo hướng dẫn của nhà sản xuất.
1.7. Các loại oxy phản ứng (ROS)
Các loại oxy phản ứng được phát hiện bằng cách sử dụng một đầu dò huỳnh quang dichloro-dihydro-fluorescein diacetate (DCFH-DA) được lấy từ Viện Công nghệ Sinh học Beyotime (Thượng Hải, Trung Quốc). Để nạp các đầu dò huỳnh quang vào tế bào, môi trường ban đầu được loại bỏ và tế bào được ủ với DCFH-DA đã được pha loãng trước đó với môi trường không có huyết thanh ở 37 ° C trong 20 phút.
Sau khi ủ, các tế bào được rửa hai lần và được khảo sát bằng cách sử dụng phương pháp phân tích đo lưu huỳnh. Định lượng ROS được thực hiện bằng cách sử dụng đầu đọc vi tấm huỳnh quang (PerkinElmer Inc., Waltham, MA, USA) với bước sóng kích thích ở 488nm và bước sóng phát xạ ở 525nm. Mức độ ROS trong mỗi giếng được bình thường hóa ở nhóm đối chứng (100%). Đồng thời, sự phát sinh ROS trong tế bào được quan sát và ghi lại bằng kính hiển vi huỳnh quang (Carl Zeiss Inc., Oberkochen, Đức).
1.8. Quá trình chết của tế bào
Quá trình tự chết của tế bào được phát hiện dựa trên Bộ công cụ phát hiện quá trình tự chết của Annexin V- FITC (Viện Công nghệ sinh học Beyotime, Thượng Hải, Trung Quốc). Sau khi tiếp xúc với PM2.5, tế bào được thu hoạch, đếm và sau đó nhuộm bằng chất huỳnh quang isothiocyanate (FITC) và propidium iodide (PI). Sau khi ủ trong bóng tối ở nhiệt độ phòng trong 20 phút, quá trình apoptosis của tế bào được phân tích bằng phương pháp đo tế bào dòng chảy (BD Life Sciences Co. Ltd., San Jose, CA, USA). Tỷ lệ apoptosis được tính toán bởi FlowJo (phiên bản 10.0, Công ty TNHH Khoa học Đời sống BD, San Jose, CA, Hoa Kỳ).
1.9. Các cytokine gây viêm
Mức độ IL-6 và IL-8 trong phần nổi của môi trường nuôi cấy sau khi tiếp xúc với PM2.5 được đánh giá bằng bộ xét nghiệm hấp thụ miễn dịch liên kết enzym (ELISA) mua từ Công ty Công nghệ sinh học Beyotime (Thượng Hải, Trung Quốc). Một cách ngắn gọn, môi trường nuôi cấy tế bào được ly tâm ở 500g trong 5 phút. Phần nổi phía trên được thu thập và xác định theo hướng dẫn của nhà sản xuất.
1.10. Phong cách phương Tây
Protein hạt nhân và protein tế bào được chiết xuất bằng bộ chiết thương mại của Công ty Công nghệ sinh học Sangon (Thượng Hải, Trung Quốc). Nồng độ protein được đo bằng bộ xét nghiệm protein BCA mua từ Công ty Công nghệ sinh học Beyotime (Thượng Hải, Trung Quốc). Sau đó, các protein được tách ra bằng cách sử dụng gel điện di 10% natri dodecylsulfate – polyacrylamide.
Sự chuyển ẩm và nitrocellulosemàng (Millipore, Billerica, MA, USA) đã được sử dụng để cho phép protein chuyển từ gel sang màng. Được chặn bằng sữa không béo 5%, các màng được ủ với các kháng thể chính: kháng Nrf2 đa dòng của thỏ (mèo. 16396–1 ‐ AP), kháng Histon H3 (mèo. 17168–1 ‐ AP) và kháng HO-1 (cat. No. 10701–1 ‐ AP) từ Công ty Công nghệ Sinh học ProteinTech Group (Vũ Hán, Trung Quốc) và chuột đơn dòng chống ACTB (cat. No. D191047) từ Công ty Công nghệ Sinh học Sangon (Thượng Hải, Trung Quốc).
Quá trình ủ với các kháng thể sơ cấp được giữ ở 4°C qua đêm. Các kháng thể thứ cấp được mua từ Công ty Công nghệ Sinh học Sangon (Thượng Hải, Trung Quốc): IgG liên hợp dê chống peroxidase ‐ từ cải ngựa (cat. No. D110087) và IgG dê liên hợp với dê kháng peroxidase Horseradish (cat. No. D110058); thuốc thử phát quang hóa học (Beyotime, Thượng Hải, Trung Quốc) và được thu giữ bởi FluorChem FC3 (Công ty Công nghệ sinh học ProteinSimple, San Jose, CA, Hoa Kỳ).
1.11. Phân tích thống kê
Phân tích thống kê được thực hiện bằng phần mềm SPSS 21.0 (SPSS Inc., Chicago, IL, USA). Dữ liệu thu được từ ba thí nghiệm độc lập được biểu thị bằng trung bình ± độ lệch (SD). Phân tích phương sai một chiều (ANOVA) theo sau là nhằm thử nghiệm nhiều phạm vi của Duncan đã được thực hiện để kiểm tra ý nghĩa giữa các nhóm. Giá trị p <0,05 được coi là có ý nghĩa thống kê. Phân tích tương quan được thực hiện bằng cách sử dụng mô hình hồi quy tuyến tính trong phần mềm R v.3.5.3 (R Foundation for Statistical Computing, Vienna, Austria).
2. Các kết quả
2.1. Đặc điểm và thành phần hóa học của PM2.5

Hình 1: Ảnh SEM của các mẫu PM2.5 dưới các độ phóng đại khác nhau (A) Thanh tỷ lệ 50,0 μm (B) Thanh tỷ lệ 10,0 μm (C) Thanh tỷ lệ 3,00 nm (D) Thanh tỷ lệ 2,00 nm (E) Thanh tỷ lệ 5,00 nm (F) Thanh tỷ lệ 2,00 nm.
Hình thái và đường kính trung bình của các mẫu thu thập được phân tích bằng SEM. Như trong Hình 1 A, bộ lọc sợi thủy tinh được cấu tạo bởi các mạng sợi xoắn và dày đặc. Hình 1 B-D trình bày một loạt các hình ảnh phóng to của các mẫu đại diện trong SEM, cho thấy rằng phần lớn các mẫu PM2.5 thu thập được dường như là các hình dạng vô định hình với đường kính trung bình dưới 500 nm. Những hình ảnh này cũng cho thấy một số hạt nhỏ có xu hướng bám chặt vào sợi thủy tinh và tập hợp lại để tạo thành các hạt lớn. Đáng chú ý, Hình 1 E-F chỉ ra rằng một phần của các mẫu PM2.5 có hình dạng bình thường. Trong khi đó, sự tán xạ ánh sáng động đã được áp dụng để xác nhận sự phân bố kích thước của các mẫu trong huyền phù.
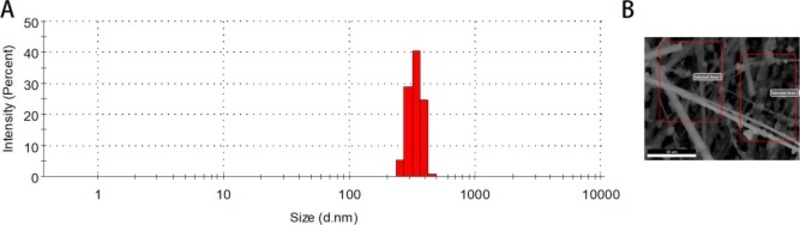
Hình 2 . Sự phân bố kích thước của các mẫu được thu thập trong huyền phù và hình thái vi mô của các khu vực được chọn để phân tích SEM-EDX.
Kết quả chỉ ra rằng các mẫu PM có dải kích thước 300–350 nm (Hình 2 A), phù hợp với kết quả SEM. Như thể hiện trong Hình 2 B và Bảng 1, bên cạnh Si và O từ bộ lọc sợi thủy tinh và vỏ trái đất, kết quả phân tích sơ bộ SEM-EDX cho thấy C là nguyên tố có nhiều nhất trong các mẫu, chiếm 58,86% trọng lượng nguyên tố còn lại. Ngoài ra, Na, K, Zn, Ca, S và các kim loại chuyển tiếp như Fe, Cu cũng được phát hiện lần lượt chiếm 11,83%, 8,45%, 6,02%, 2,07%, 0,82%, 4,75% và 2,37%.
| Yếu tố | Trọng lượng % | % Nguyên tử | Tỷ lệ nhập ròng |
| O | 33,91 | 37.47 | 596,9 |
| C | 28,76 | 42.32 | 210.11 |
| Si | 17,23 | 10,85 | 1774,56 |
| Na | 5,78 | 4,45 | 233,16 |
| K | 4,13 | 1,92 | 178,13 |
| Zn | 2,94 | 0,8 | 56,99 |
| Fe | 2,32 | 0,63 | 61.48 |
| Al | 2,12 | 1,39 | 182,87 |
Bảng 1. Các nguyên tố và nồng độ trung bình (so với nguyên tố K) của các khu vực đã chọn của PM2.5.
ICP-OES được tiến hành để nghiên cứu sâu hơn về thành phần và nồng độ của các nguyên tố kim loại trong mẫu. Kết quả từ ICP-OES cho thấy các nguyên tố lớp vỏ bao gồm K, Fe, Na, Ca, Al và Mg chiếm gần 81% tổng số nguyên tố kim loại (Bảng 2). Trong số các nguyên tố từ nguồn nhân tạo, Zn có nhiều nhất, chiếm 8,55% tổng số nguyên tố kim loại (Bảng 2).
Bên cạnh các nguyên tố kim loại, PAHs là một yếu tố quan trọng khác góp phần vào khả năng gây độc của PM2.5. Bảng 2 cũng liệt kê 16 loại PAH được tìm thấy trong các mẫu không khí. Trong số đó, acenaphthylene và acenaphthene có mặt chủ yếu, chiếm 49,65% tổng số PAH. Anthracene không được phát hiện trong các mẫu. Các ion hòa tan trong nước được xác định bằng IC. Như mô tả trong Bảng 2 , SO 4 2 − có nồng độ cao nhất, chiếm 20,47 ± 8,26 ng/m 3. Nồng độ của NH 4+ , Cl- và NO 3- lần lượt là 9,68 ± 1,31, 3,85 ± 1,79 và 12,69 ± 5,81 ng/m 3.
| Các phần tử kim loại (ng/m 3) | PAHs (ng/m 3 ) | PAHs (ng/m 3 ) | Các ion hòa tan trong nước (ng/m3) |
| K 2638,91 | Naphtalen 0,13 | Benzo (k) flo 0,45 | NH 4 + 9,68 ± 1,31 |
| Fe 2432,14 | Axetilen 3,46 | Benzo(a)pyren 0,23 | Cl – 3,85 ± 1,79 |
| Na 2314.32 | Acenaphthene 0,83 | Dibenzo(a,h) anthracen 0,67 | SO 4 2− 20,47 ± 8,26 |
| Ca 2201.82 | Flo 0,26 | Benzo(g,h,i) perylene 0,26 | KHÔNG 3 – 12,69 ± 5,81 |
| Al 1458,24 | Phenanthrene 0,11 | Indeno 0,54 | |
| Mg 1288,89 | Anthracen ND | ||
| Zn 1262,97 | Flo 0,16 | ||
| Pb 365.43 | Pyrene 0,22 | ||
| Có TK 322,43 | Chrysene 0,32 | ||
| Mn 291.35 | Benzo (a) anthracen 0,49 | ||
| Cu 199,26 | Benzo (b) flo 0,51 |
Bảng 2. Nồng độ của các nguyên tố kim loại, PAH và các ion tan trong nước trong các mẫu thu được.
Lưu ý: ND, không phát hiện; Các nguyên tố kim loại khác (không được liệt kê trong bảng, nồng độ trung bình <80 ng / m 3 ) bao gồm Ni, V, As, Se, Ba, Sr, Rb, Mo, Cd, Sb, Ce, Co, Cs và La, cũng phát hiện trong các mẫu.
2.2. Ảnh hưởng của PM2.5 và Sulforaphane đến khả năng tồn tại của tế bào HBE
Thử nghiệm CCK-8 được thực hiện để xác định độc tính của PM2.5. Như được chỉ ra trong Hình 3 A-C, sự suy giảm khả năng sống của tế bào phụ thuộc vào thời gian và liều lượng đã được quan sát thấy ở các nhóm được điều trị bằng PM2.5. Đáng chú ý, so với nhóm đối chứng, ủ với 300 μg / mL PM2.5 trong 48 giờ làm giảm khả năng sống của tế bào xuống 63,54 ± 3,76% (p <0,01). Đồng thời, đối với Sulforaphane, điều trị bằng Sulforaphane dưới 8μM không có ảnh hưởng đáng kể đến khả năng sống sót của tế bào HBE (p > 0,05) (Hình 3 D-F). Các thí nghiệm này được thực hiện để xác định nồng độ và thời gian ủ tối ưu PM2.5 và Sulforaphane cho các thí nghiệm tiếp theo. Do đó, dựa trên những kết quả này, tiền xử lý với Sulforaphane dưới 8 μM và ủ với 300 μg/mL PM2.5 đã được sử dụng trong các đánh giá sau đây.
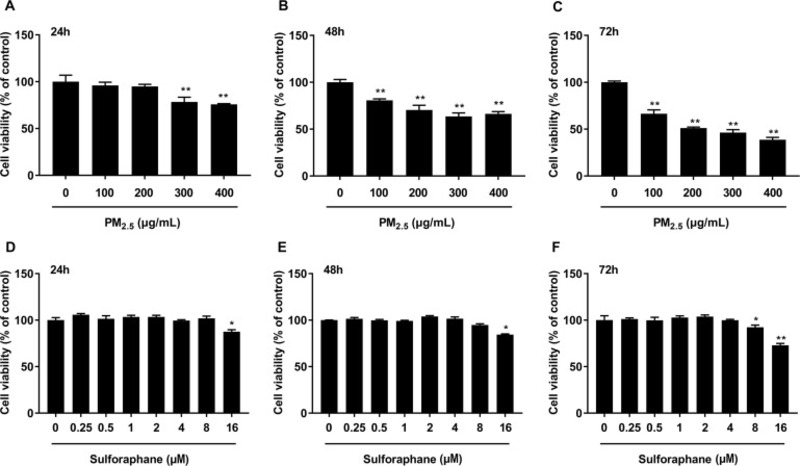
Hình 3. Ảnh hưởng của PM2.5 và sulforaphane đến khả năng sống sót của tế bào HBE. Tế bào HBE được ủ với PM2.5 (100–400 μg / mL) (A, B, C) và Sulforaphane (0,25–16 μM) (D, E, F) trong 24, 48 và 72 giờ. Khả năng sống của tế bào được đánh giá bằng xét nghiệm CCK-8 sau khi ủ. Dữ liệu được trình bày dưới dạng phương tiện ± SD dựa trên ba thí nghiệm độc lập (n = 3). * p <0,05 và ** p <0,01, so với nhóm chứng.
2.3. Sulforaphane làm giảm bớt căng thẳng oxy hóa do PM2.5 gây ra
Trong phần này, một số dấu ấn sinh học liên quan đến stress oxy hóa đã được xác định, bao gồm khả năng tồn tại của tế bào, sự giải phóng LDH , hàm lượng MDA và mức độ ROS. Như thể hiện trong Hình 4 A, ở các nhóm được điều trị trước bằng Sulforaphane, so với các nhóm được điều trị chỉ với PM2.5, khả năng sống của tế bào tăng lên đều đặn (1 μM SFN, 68,76 ± 2,90%, p <0,05; 2 μM SFN, 74,13 ± 1,54%, p <0,01; 4 μM SFN, 79,56 ± 2,46%, p <0,01).
Đáng chú ý, so với nhóm đối chứng tích cực, khả năng sống sót của các tế bào được điều trị bằng 4 μM Sulforaphane đã tăng lên 79,56 ± 2,46%. Trong khi đó, không có sự khác biệt rõ ràng giữa nhóm được xử lý 5 μM SFN và nhóm đối chứng, cho thấy rằng tiền xử lý bằng Sulforaphane không ảnh hưởng đến khả năng sống sót của tế bào HBE (p > 0,05). Hàm lượng LDH trong phần nổi được thu thập từ các tế bào từ các nhóm xử lý khác nhau được thể hiện trong Hình 4 B.
Kết quả chỉ ra rằng, so với các tế bào của nhóm đối chứng dương tính (185,24 ± 5,37%, p<0,01), lactate dehydrogenase trong phần nổi của các tế bào được điều trị bằng Sulforaphane giảm theo cách phụ thuộc vào liều lượng (1 μM SFN, 163,21 ± 7,50%, p <0,05; 2 μM SFN, 144,45 ± 9,38%,p <0,01; 4 μM SFN, 138,64 ± 13,79%, p <0,01). Kết quả xét nghiệm MDA phù hợp với kết quả giải phóng LDH, cho thấy sự giảm đáng kể ở nhóm được điều trị bằng Sulforaphane 4 μM (129,26 ± 3,29%, p <0,01) như trong Hình 4 C. Nó chứng minh rằng mức ROS dương tính nhóm chứng tăng rõ rệt lên đến 309,93 ± 9,68% ( p <0,01), so với nhóm chứng âm tính ( Hình 4 D). Tuy nhiên, trong các tế bào của nhóm được xử lý trước SFN, mức ROS thấp hơn đáng kể so với nhóm đối chứng dương tính (1 μM SFN, 233,34 ± 7,18%, p <0,05; 2 μM SFN, 187,83 ± 11,82%, p <0,01; 4 μM SFN, 161,64 ± 10,79%, p <0,01).
Bên cạnh việc định lượng ROS trong tế bào, kết quả hình ảnh từ kính hiển vi huỳnh quang xác nhận rằng tiền xử lý Sulforaphane gây ra sự giảm ROS phụ thuộc vào liều lượng trong tế bào HBE (Hình 5). Như thể hiện trong Hình 5 D-E, việc xử lý trước 2 và 4 μM SFN đã làm giảm đáng kể cường độ huỳnh quang đến mức có thể so sánh với các tế bào bình thường không được xử lý. Đáng lưu ý, so với các tế bào nhóm chứng âm tính, điều trị với 5 μM SFN không gây ra những thay đổi đáng kể về hàm lượng MDA hoặc mức ROS của tế bào HBE (p>0,05). Dựa trên những kết quả ban đầu này, điều trị bằng Sulforaphane sẽ có hiệu quả trong việc giảm căng thẳng oxy hóa do PM2.5 gây ra trong tế bào HBE.
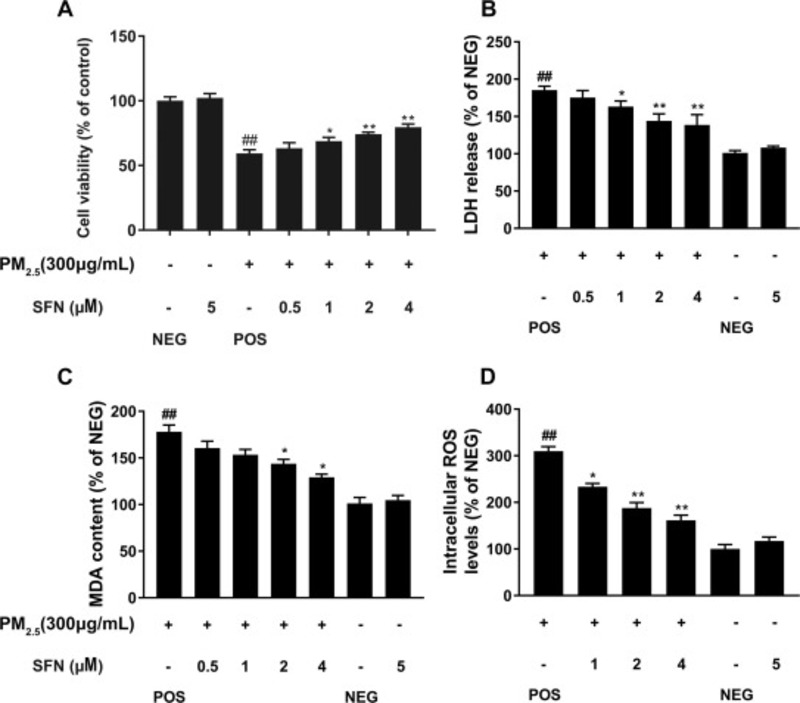
Hình 4. Tiền xử lý SFN làm giảm các thiệt hại do oxy hóa gây ra bởi PM2.5, bao gồm khả năng tồn tại của tế bào (A), sự giải phóng LDH (B), hàm lượng MDA (C) và mức ROS nội bào (D). Dữ liệu được trình bày dưới dạng phương tiện ± SD dựa trên ba thí nghiệm độc lập (n = 3). * p <0,05 và ** p <0,01, so với nhóm chứng.
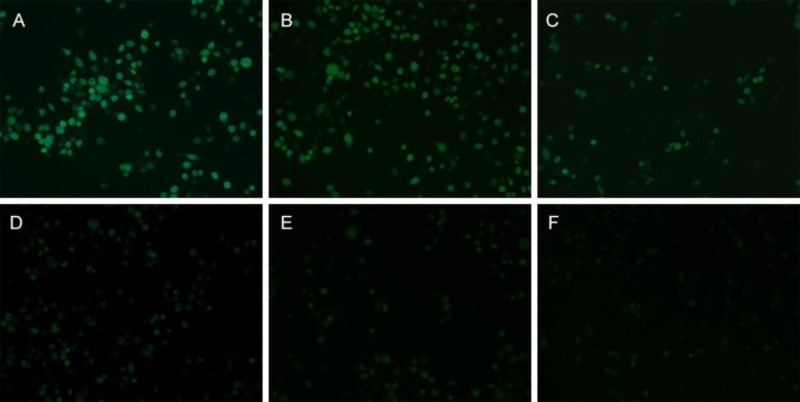
Hình 5. Tiền xử lý SFN làm giảm bớt sự tích tụ ROS do PM2.5 gây ra trong tế bào HBE. Phát hiện huỳnh quang mức ROS trong các tế bào được xử lý bằng PM2.5 hoặc PM2.5 cùng với các nồng độ sulforaphane khác nhau. (A) nhóm đối chứng dương tính, các tế bào được điều trị chỉ với PM2.5. (B) SFN 1 + PM2.5 (300 μg / mL). (C) SFN 2 + PM2.5 (300 μg / mL). (D) SFN 4 + PM2.5 (300 μg / mL). (E) nhóm đối chứng âm tính, các tế bào được xử lý không có SFN hoặc PM2.5. (F) Nhóm kiểm soát SFN, các tế bào được xử lý bằng 5 μM SFN.
2.4. Ảnh hưởng của sulforaphane đối với quá trình chết rụng tế bào do PM2.5 gây ra
Theo kết quả nhuộm Annexin V-FITC và PI (Hình 6 C), tỷ lệ chết bao gồm tế bào chết sớm và tế bào chết muộn ở các tế bào được xử lý PM2.5 cao hơn. Như được mô tả trong Hình 6 C, so với các tế bào của nhóm đối chứng âm tính, tiếp xúc với PM2.5 làm tăng đáng kể tỷ lệ tế bào chết theo chương trình (21,24 ± 2,82%, p <0,01). Tuy nhiên, việc ủ trước với Sulforaphane 2 và 4 μM đã làm giảm đáng kể quá trình tự chết của tế bào trong các tế bào HBE, làm giảm tỷ lệ chết rụng xuống lần lượt là 15,64 ± 2,42% ( p <0,05) và 13,17 ± 1,90% ( p <0,01).

Hình 6. SFN trước khi điều trị làm giảm phản ứng viêm do PM2.5 gây ra và quá trình apoptosis. (A) Tiền xử lý bằng sulforaphane làm giảm mức IL-6 trong các tế bào tiếp xúc với PM2.5. (B) Tiền xử lý bằng sulforaphane làm giảm mức IL-8 trong các tế bào tiếp xúc với PM2.5. (C) Tiền xử lý bằng sulforaphane làm giảm tỷ lệ tự chết của tế bào. Dữ liệu được trình bày dưới dạng phương tiện ± SD dựa trên ba thí nghiệm độc lập (n = 3). * p <0,05 và ** p <0,01, so với nhóm chứng. ## p <0,01, so với nhóm chứng âm tính.
2.5. Sulforaphane làm giảm bớt tình trạng viêm do PM2.5 gây ra
Như được thể hiện trong Hình 6 A-B, so với các tế bào của nhóm đối chứng âm tính, việc tiếp xúc với PM2.5 làm tăng đáng kể việc tiết IL-6 (293,91 ± 2,35%, p <0,01) và IL-8 (178,32 ± 5,52%, p <0,01) từ các tế bào HBE. Tiền xử lý bằng Sulforaphane gây ra sự giảm tiết IL-6 trong tế bào HBE (1 μM SFN, 178,2 ± 5,9%, p <0,01; 2 μM SFN, 184,15 ± 3,79%, p <0,01; 4 μM SFN, 127,59 ± 3,48%, p<0,01). Mặc dù 1 và 2 μM Sulforaphane không ức chế đáng kể sự bài tiết IL-8 ở phần nổi của môi trường nuôi cấy tế bào (p >0,05), 4 μM Sulforaphane vẫn làm giảm đáng kể nồng độ IL-8 trong phần nổi của môi trường nuôi cấy (p <0,05).
2.6. Sulforaphane làm giảm các tổn thương do oxy hóa thông qua việc kích hoạt con đường chống oxy hóa Nrf2 / Keap1
Như được thể hiện trong Hình 7, so với các tế bào của nhóm đối chứng âm tính, việc tiếp xúc với PM2.5 làm giảm đáng kể mức độ hạt nhân Nrf2 và gen đích HO-1 của nó trong các tế bào HBE. Trong khi điều trị bằng Sulforaphane một mình có thể làm tăng mức độ hạt nhân của Nrf2 và tế bào chất mức HO-1. Đồng thời, ủ trước bằng Sulforaphane đã làm tăng đáng kể mức độ hạt nhân Nrf2 và HO-1 trong các tế bào nhóm được xử lý PM2.5. Hơn nữa, ủ trước với 4 μM Sulforaphane có thể tạo ra mức hạt nhân Nrf2 và HO-1 cao hơn so với các tế bào nhóm PM2.5 được xử lý trước bằng 1 μM Sulforaphane.
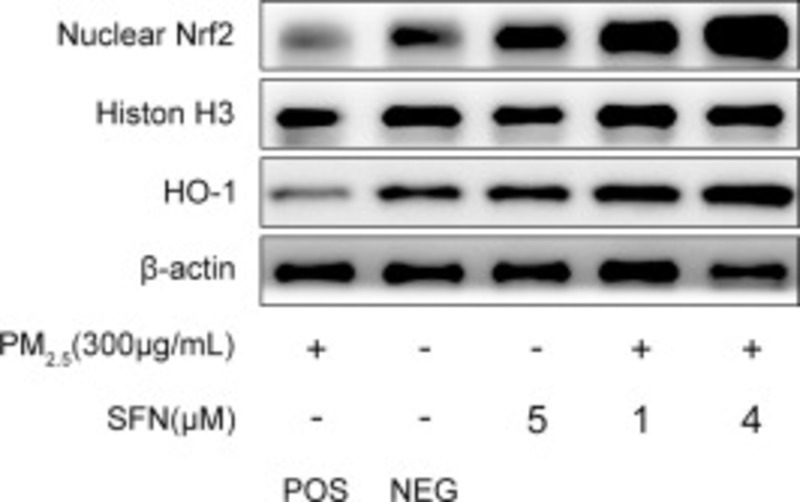
Hình 7. SFN bảo vệ các tế bào HBE chống lại các tổn thương oxy hóa do PM2.5 gây ra thông qua việc kích hoạt con đường chống oxy hóa Nrf2 / Keap1 . Mức độ biểu hiện của hạt nhân Nrf2 và HO-1 đã được phát hiện bởi Western blot . Mật độ của protein hạt nhân tương đối với Histon H3. Mật độ của tổng số protein tương đối với β-actin.
Kết luận
Đặc điểm của các hạt PM2.5 chứng minh rằng các mẫu thu thập được là các hạt mịn có đường kính trung bình<500 nm và có nhiều kim loại chuyển tiếp như Cu và Fe và PAHs như acenaphthylene và acenaphthene, góp phần gây ra các tổn thương oxy hóa và phản ứng viêm của nó.
Ngoài ra, nghiên cứu của chúng tôi cho thấy PM2.5 gây ra căng thẳng oxy hóa và phản ứng viêm trong tế bào HBE, cuối cùng dẫn đến sự ức chế sự phát triển của tế bào và thậm chí là quá trình chết tế bào. Mặc dù Sulforaphane từ lâu đã được coi là chất cảm ứng Nrf2 mạnh với các đặc tính chống oxy hóa, chống viêm và chống ung thư, nhưng vẫn chưa rõ liệu nó có thể phát huy tác dụng bảo vệ chống lại các tổn thương do PM2.5 gây ra ở các tế bào khỏe mạnh có nguồn gốc từ con người hay không.

Trong nghiên cứu này, các nhà khoa học đã chứng minh rằng việc bổ sung Sulforaphane làm giảm đáng kể các tổn thương do PM2.5 gây ra đối với các tế bào HBE có nguồn gốc từ các cá thể không ung thư, bao gồm sự tích tụ ROS, ức chế tăng trưởng tế bào, suy giảm tính toàn vẹn của màng tế bào, sự suy giảm của khả năng tồn tại của tế bào, tỷ lệ apoptosis của tế bào, cũng như việc giải phóng các cytokine gây viêm. Các nhà nghiên cứu cũng đưa ra giả thuyết rằng cơ chế điều hòa lộ trình truyền tín hiệu Nrf2-ARE và NF-κB có thể là cơ chế phân tử cơ bản chịu trách nhiệm về tác dụng bảo vệ của Sulforaphane – giảm căng thẳng oxy hóa và viêm.
Đáng chú ý, ngoài hoạt tính sinh học mạnh, Sulforaphane cũng có tính khả dụng cao ở người vì >70% Sulforaphane có thể được hấp thụ và chuyển hóa thành dithiocarbamat (theo Fahey, Wehage, Holtzclaw, Kensler, Egner, Shapiro, & Talalay, 2012). Do đó, dựa trên hoạt tính sinh học, khả dụng sinh học, nguồn gốc và giá cả, Sulforaphane có thể là một lựa chọn thay thế để làm giảm các tác động tiêu cực đến sức khỏe do PM2.5 gây ra. Kết hợp với nhau, nghiên cứu này cung cấp cơ sở lý thuyết về Sulforaphane như một hợp chất hoạt tính sinh học có nguồn gốc thực phẩm đầy hứa hẹn chống lại các tổn thương do PM2.5 gây ra trong các thử nghiệm lâm sàng và in vivo. Cùng với đó là làm sáng tỏ sự phát triển của các chất ngăn ngừa ô nhiễm không khí có nguồn gốc từ thực phẩm.
Bên cạnh việc kiểm soát chính sách và điều trị y tế, các can thiệp dinh dưỡng như bổ sung đầy đủ các hợp chất hoạt tính sinh học có nguồn gốc từ thực phẩm có thể là một cách khả thi và hiệu quả để giảm các tác động tiêu cực đến sức khỏe liên quan đến các chất dạng hạt mịn trong tương lai. Có thể giảm căng thẳng oxy hóa và tình trạng viêm nhờ Sulforaphane
